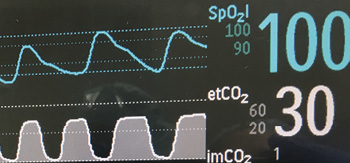
Figura 1: Representaciones de formas de ondas continuas de oximetría de pulso y capnografía.
En 2006 y 2011, la Anesthesia Patient Safety Foundation (APSF) realizó conferencias multidisciplinarias para abordar el grave problema de seguridad del paciente que representa el deterioro respiratorio inducido por opioides (Opioid-Induced Ventilatory Impairment, OIVI) en el período posoperatorio.1Debido a la importancia del problema y a que no existe una mejor supervisión para la detección de eventos adversos relacionados con el OIVI, las recomendaciones en consenso de los participantes de la conferencia de 2011 fueron que, hasta que existan mejores monitores, debe utilizarse la oximetría de pulso continua (preferentemente con alarmas centralizadas y sistemas de localización) para supervisar a los pacientes que no reciben oxígeno suplementario, y se sugiere el uso de monitores de ventilación (capnografía) para aquellos pacientes que reciben oxígeno suplementario.
En 2017 y en el contexto de la discusión nacional que rodea la crisis de opioides, es más relevante que nunca revisar el estado actual del monitoreo para la detección de OIVI y proporcionar recomendaciones actualizadas basadas en evidencias.
Incidencia del deterioro respiratorio inducido por opioides
Durante mucho tiempo ha sido un desafío medir exactamente la incidencia del OIVI y, posteriormente, medir la ventaja de seguridad de un nuevo protocolo o tecnología de monitoreo. La taxonomía irregular de la depresión respiratoria que existe en la literatura obstaculiza los estudios comparativos.2 Las diferentes definiciones utilizadas como sustitutos para la identificación de la depresión respiratoria hacen que la determinación de la incidencia actual resulte desafiante. Algunas medidas sustitutas para definir la depresión respiratoria incluyen hipoxemia, hipopnea, hipoventilación hipercápnica, frecuencia respiratoria disminuida y ventilación por minuto, entre otras.2 Las definiciones utilizadas para clasificar la hipoxemia que existen en la literatura se extienden entre el 80 y el 94 % de saturación periférica de oxígeno (SpO2).3 Con la advertencia de que se utilizan muchas medidas diferentes para la depresión respiratoria, se reportó la incidencia del OIVI en un rango del 0,15 % al 1,1 % de todos los pacientes posquirúrgicos.3-8 A pesar de que la tasa de incidencia del OIVI varía según la definición que se emplee, hay estudios recientes que siguen reportando la incidencia del OIVI dentro de este mismo rango.2 Al parecer está claro que es necesario estandarizar la taxonomía y las medidas de los resultados de la depresión respiratoria, de manera que la investigación enfocada en la reducción de riesgos pueda realizar los avances pertinentes. Además de determinar “qué monitorear”, debemos decidir cuándo es necesario el monitoreo (abordado en un artículo adjunto, Deberíamos centrarnos en “cuándo” y en “a quién” debemos monitorear para detectar el deterioro ventilatorio inducido por opioides en el período posoperatorio), así como los recursos adecuados para reducir la incidencia de este problema.
Cuándo es necesario el monitoreo
La somnolencia y la sedación son los precursores más comunes que conducen al OIVI.2,9 La supervisión regular por parte del personal de enfermería es actualmente el principal medio de supervisión de este fenómeno. La determinación de la frecuencia necesaria de la evaluación por parte del personal de enfermería requiere el logro de un equilibrio entre la reducción de interrupciones del paciente, la interferencia en el flujo de trabajo del personal de enfermería y los gastos de asignación de personal. Para los pacientes posoperatorios, las primeras cuatro horas después del alta de la unidad de cuidados posteriores a la anestesia (Post-Anesthesia Care Unit, PACU) representan el período asociado a las tasas más elevadas de sedación, y más de la mitad de los eventos de OIVI ocurre en las primeras 12 horas después de la operación cirugía. Además, el 75 % de todos los eventos de OIVI ocurren en las primeras 24 horas después de la operación quirúrgica.2 Con base en el tiempo del OIVI posoperatorio, probablemente sería útil enfatizar más el monitoreo en las primeras 24 horas para reducir los eventos adversos de los opioides.
En 2014, los Centros de Servicios de Medicare y Medicaid (Centers for Medicare and Medicaid Services, CMS) actualizaron sus recomendaciones para la administración hospitalaria de opioides para incluir evaluaciones de enfermería en serie con mediciones de presión arterial, temperatura, pulso, frecuencia respiratoria, nivel de dolor, estado respiratorio y nivel de sedación.10 Sin embargo, aún no se ha establecido cuál es la frecuencia óptima de las evaluaciones, lo cual probablemente dependa de diversos factores, que incluyen el tipo de dolor, la idoneidad del alivio del dolor inicial, la presencia de efectos secundarios, comorbilidades y cambios en el estado clínico. En el caso de pacientes que reciben opioides neuroaxiales, el grupo de trabajo enfocado en opioides neuroaxiales de la American Society of Anesthesiologists y la American Society of Regional Anesthesia and Pain Medicine sugieren realizar el monitoreo cada 1 hora durante las primeras 12 horas, cada 2 horas durante las siguientes 12 horas y después cada 4 horas si no ocurren complicaciones relacionadas con los opioides.11 Por el contrario, el panel de expertos respaldado por los CMS recomendaron que para cualquier administración de opioides se realice el monitoreo cada 2,5 horas (por demoras en la documentación) durante las primeras 24 horas y después cada 4,5 horas. Sin embargo, durante una encuesta de los hospitales de los CMS, solo el 8,4 % de los encuentros con pacientes con analgesia controlada por el paciente (Patient-Controled Analgesia, PCA) a través de opioides intravenosos cumplieron con el estándar de monitoreo cada 2,5 horas, y solo el 26,8 % cumplió con el estándar más relajado de monitoreo cada 4,5 horas.12 Debido a la variación en las recomendaciones de monitoreo de diferentes organizaciones, los diferentes factores de riesgo del paciente, los diferentes planes de anestesia, las diferentes personas que recetan y la educación de enfermería con respecto al OIVI, además de las variables relaciones enfermera-paciente, el monitoreo electrónico continuo posoperatorio para todos los pacientes que reciben opioides es probable que simplifique la atención y mejore la detección de OIVI.
Cómo se debe monitorear a los pacientes: sistemas de monitoreo y de alerta
Independientemente del sistema de supervisión electrónica específico que se use para detectar el OIVI, es necesario abordar el método para alertar a los profesionales de atención médica cuando ocurren estos eventos para asegurar la eficacia del sistema. Es de vital importancia el establecimiento de alertas de monitoreo basadas en evidencias que sean útiles para detectar el OIVI. Los umbrales de alerta establecidos de manera inadecuada conducen a fatiga de alarma, irritación de los pacientes y del personal y autocomplacencia. Todo esto puede hacer que incluso el sistema de supervisión más eficaz sea totalmente ineficaz para lograr el resultado deseado.2
Idealmente, los sistemas de monitoreo deberían usar varios parámetros sincronizados para detectar cualquier indicador de depresión respiratoria que pueda surgir primero y emplear combinaciones de medidas para identificar con exactitud un evento inminente. En el pasado, las alarmas de umbral han sido bastante simples y propensas a errores.
En la actualidad, la oximetría de pulso es el método más común disponible para supervisar la depresión respiratoria en los sistemas hospitalarios. Sin embargo, las alarmas de umbral de la oximetría de pulso a menudo son las más problemáticas. Establecer umbrales demasiado altos conduce a falsos positivos frecuentes, mientras que los umbrales demasiado bajos pueden conducir a respuestas tardías a la depresión respiratoria. La administración de oxígeno suplementario complica el problema de supervisión, porque puede demorar la detección de ventilación reducida y causar más daño al impulso respiratorio hipóxico.13
La capnografía, si se usa sola, también tiene limitaciones. Por lo general, la capnografía es cualitativa y no cuantitativa en pacientes no intubados; por lo tanto, proporciona una indicación de la presencia de dióxido de carbono durante la ventilación normal, cambios relativos en el dióxido de carbono exhalado y cierta información sobre la frecuencia respiratoria. Sin embargo, la detección de cambios en los valores de dióxido de carbono (CO2 ), ya sean reducidos o aumentados, puede ser problemática e inexacta. Aun así, la capnografía puede ser útil para monitorear la frecuencia respiratoria, ya que la naturaleza periódica de la exhalación de CO2 y la caída a cero durante la exhalación proporcionan una demarcación clara del ciclo respiratorio. Los umbrales superiores de la frecuencia respiratoria también se pueden usar con la capnografía para detectar la hiperventilación.
Combinar la frecuencia respiratoria con la oximetría y la capnografía ayuda a proporcionar información adicional para la detección de OIVI, así como otros procesos de la enfermedad (Figura 1). Curry et al. describieron tres patrones de depresión respiratoria que ocasionan la muerte inesperada.14 El tipo I es una dificultad respiratoria compensada con hiperventilación (p. ej., debido a sepsis, émbolos pulmonares o insuficiencia cardíaca congestiva). En el tipo II, los pacientes inicialmente tienen una saturación de oxígeno estable y se reduce la presión parcial de dióxido de carbono (PaCO2 ) a medida que se establece la acidosis metabólica y empieza la hiperventilación compensatoria. La frecuencia respiratoria acelerada es un sello distintivo de este tipo de insuficiencia respiratoria. Ocasionalmente, una desaturación lenta antecede a una disminución precipitada en la SpO2 cuando falla la respuesta ventilatoria al empeoramiento de la acidosis. Los monitores más actuales tienen alarmas de frecuencia respiratoria baja, pero no necesariamente las alarmas de frecuencia respiratoria rápida ni la configuración alta detectan la insuficiencia respiratoria demasiado tarde. La depresión respiratoria tipo II es una hipoventilación unidireccional progresiva o un evento de narcosis por CO2 . En este caso, a menudo debido a una sobredosis de opioides o de otros sedantes, los pacientes primero tienen una elevación en la PaCO2 (y en el dióxido de carbono espiratorio final o EtCO2) a causa de la reducción en la ventilación por minuto, frecuentemente mientras la SpO2 aún es >90 %. La depresión respiratoria tipo III es una reducción de saturación de oxígeno/flujo de aire de vigilancia rápida con caída precipitada de la SpO2 que se puede observar en pacientes con apnea obstructiva del sueño. En esta situación, el paciente depende del estado de estimulación para mantener la oxigenación. Si falla la estimulación, el paciente sufre una hipoxemia precipitada durante la apnea, que puede conducir a un paro repentino.
Actualmente, no existe un solo sistema de monitoreo ni un conjunto de umbrales de alarma comprobados con la capacidad de detectar todos los patrones respiratorios que dan lugar a eventos de muerte inesperada. La sensibilidad general a eventos incipientes se puede aumentar utilizando varios monitores para detectar los patrones de cambio.
Tecnologías más modernas de supervisión y algoritmos de alerta
Como se indicó anteriormente, la fuerza de trabajo a menudo enfrenta limitaciones para lograr la supervisión constante y de alta frecuencia que se requiere para capturar con exactitud los eventos adversos, y las alarmas de monitor único tienen capacidades limitadas. Se toman iniciativas constantes para desarrollar y validar nuevos monitores con sistemas de alerta más inteligentes.
Los algoritmos que combinan varios parámetros fisiológicos individuales para producir un solo umbral de “superfusión” pueden aumentar la sensibilidad de los sistemas de umbral mientras se evitan las falsas alarmas. Un ejemplo es la puntuación de advertencia temprana modificada (Modified Early Warning Score, MEWS).14La MEWS es una alarma de umbral aditiva simple que combina varios monitores en un número para fines de documentación y alertas. Los futuros algoritmos inteligentes deberían analizar los patrones de cambio con combinaciones de signos vitales en lugar de solo acumular los umbrales de monitores individuales. Estos sistemas deberían predecir la trayectoria hacia la depresión respiratoria antes de que ocurra un evento, permitiendo las respuestas tempranas y la reducción en la morbilidad.
Los sistemas de administración de medicamentos y el monitoreo integrados, como la capnografía y la oximetría de pulso, combinados con dispositivos de PCA intravenosa, permiten asociar el monitoreo a la respuesta.15 Un monitor que pueda integrar varios sensores y que, a través del uso de un algoritmo de reconocimiento de patrones, detecte los signos tempranos de la depresión respiratoria puede bloquear funcionalmente la administración del opioide mientras alerta al personal médico.16
La frecuencia respiratoria se puede medir durante la capnografía con cambios en el flujo de aire de la sonda de muestreo de CO2 . Sin embargo, también se evaluaron métodos alternativos para detectar la frecuencia respiratoria. El monitoreo acústico es interesante porque puede realizarse sin tener contacto directo con el paciente. Este método es especialmente atractivo para usarlo en niños, ya que mantener una sonda de muestreo en los niños puede ser difícil.17 Sin embargo, la supervisión acústica ha estado plagada de errores que conducen a la fatiga de alarma.18 Los sistemas de radar que supervisan la ventilación mediante el montaje de un sistema de sensor en la pared o el techo de la habitación se están evaluando, pero también tienen limitaciones debido a errores de movimiento y a falsas alarmas.19
La bioimpedancia es una tecnología que utiliza cambios en la conductancia eléctrica del tórax obtenida con electrodos de superficie para calcular la frecuencia respiratoria, la ventilación por minuto, el volumen tidal y los eventos de apnea. Existen estudios que han demostrado que este tipo de monitor de volumen respiratorio (Respiratory Volume Monitor, RVM) puede detectar cambios en la ventilación por minuto y en la depresión respiratoria incipiente más rápidamente y en mayor grado que la capnografía sola.20 Un estudio determinó que el RVM puede detectar el inicio de la depresión respiratoria más de 12 minutos antes del inicio de la desaturación.21 En particular, los pacientes que reciben oxígeno suplementario a menudo mostraron señales de ventilación por minuto baja al utilizar RVM sin que se presenten alarmas de desaturación. Uno de los principales problemas de las implementaciones actuales de los monitores de bioimpedancia es la necesidad de colocarle electrodos de superficie al paciente para conectarlo físicamente a un dispositivo que analiza el movimiento. Además, el movimiento no respiratorio, como la tos o un cambio de posición, puede generar señales falsas. Por último, el movimiento de la pared torácica sin intercambio de aire, como ocurre con la obstrucción de las vías respiratorias, también puede “engañar” a algunos dispositivos de bioimpedancia (Tabla 1).17
Tabla 1: Ventajas y desventajas de los dispositivos de monitoreo electrónico continuo
| ACÚSTICO | PARÁMETROS | VENTAJAS | DESVENTAJAS |
| Oximetría de pulso | SpO2 HR |
|
|
| Capnografía | EtCO2
RR |
|
|
| Umbral combinado (MEWS) | RR HR (SBP UOP Temp. Estado neurológico) |
|
|
| Dispositivos de administración y supervisión integrados | SpO2 EtCO2 RR |
|
|
| Monitor acústico | RR |
|
|
| Monitor de radar | RR |
|
|
| Bioimpedancia | RR TV MV |
|
|
| Pletismografía de inductancia y audiometría | RR SpO2 Permeabilidad de las vías respiratorias |
|
|
| SpO2 : saturación periférica de oxígeno HR: frecuencia cardíaca EtCO2 : dióxido de carbono espiratorio final RR: frecuencia respiratoria SBP: presión arterial sistólica |
UOP: diuresis TV: volumen tidal MV: ventilación por minuto UCI: unidad de cuidados intensivos |
Los sistemas integrados más complejos que combinan la pletismografía de inductancia respiratoria con la audiometría y la oximetría de pulso son muy sensibles para detectar la depresión respiratoria. Sin embargo, los sistemas actuales son muy incómodos y difíciles de usar para los pacientes, están sujetos a artefactos de movimiento y tienen limitaciones similares con movimientos falsos de la pared torácica, como la tos o el llanto, como ocurre con otros dispositivos de bioimpedancia.17
Conclusiones: Un futuro ideal
En un futuro ideal ningún paciente sufrirá daños a causa del OIVI posoperatorio. Para lograr este objetivo, necesitaremos analgésicos alternativos que sean tan eficaces como los opioides, pero que no causen depresión respiratoria. Hasta entonces, debemos reducir el riesgo de los medicamentos opioides que usamos actualmente. Esto se llevará a cabo mediante el uso inteligente de recursos de enfermería en combinación con sistemas de monitoreo avanzados que sean sensibles para detectar eventos respiratorios incipientes. Para facilitar este futuro, los participantes clave deben ayudar a delinear una taxonomía para eventos adversos relacionados con opioides, incluida la depresión respiratoria, con directrices de acompañamiento y medidas de los resultados.
El Dr. Gupta es profesor asociado de Anestesiología en el Vanderbilt University Medical Center en Nashville, TN.
El Dr. Edwards es profesor asistente de Anestesiología, Cirugía Neurológica en el Vanderbilt University Medical Center en Nashville, TN.
Ninguno de los autores tiene conflictos de interés para declarar en relación con este artículo.
Referencias
- Weinger M, Lee LA. No patient shall be harmed by opioid-induced respiratory depression. APSF Newsletter 2011;26:21. Available at https://dev2.apsf.org/newsletters/html/2011/fall/01_opioid.htm. Accessed December 9, 2017.
- Jungquist CR, Smith K, Nicely KLW, et al. Monitoring hospitalized adult patients for opioid-induced sedation and respiratory depression. Am J Nurs 2017;117:S27–S35.
- Sun Z, Sessler DI, Dalton JE, et al. Postoperative hypoxemia is common and persistent: a prospective blinded observational study. Anesth Analg 2015;121:709–15.
- Wheatley RG, Somerville ID, Sapsford D, et al. Postoperative hypoxaemia: comparison of extradural, i.m. and patient-controlled opioid analgesia. Br J Anaesth1990;64:267–75.
- Overdyk FJ, Carter R, Maddox RR, et al. Continuous oximetry/capnometry monitoring reveals frequent desaturation and bradypnea during patient-controlled analgesia. Anesth Analg 2007;105:412–8.
- Dahan A, Aarts L, Smith TW. Incidence, reversal, and prevention of opioid-induced respiratory depression. Anesthesiology 2010;112:226-38.
- Stites M, Surprise J, McNiel J, et al. Continuous capnography reduces the incidence of opioid-induced respiratory rescue by hospital rapid resuscitation team. J Patient Saf 2017 Jul 20. doi: 10.1097/PTS.0000000000000408. [Epub ahead of print].
- Cavalcante AN, Sprung J, Schroeder DR, et al. Multimodal analgesic therapy with gabapentin and its association with postoperative respiratory depression. Anesth Analg 2017;125:141–6.
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659–65.
- https://www.cms.gov/Medicare/Provider-Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-15.pdf. Accessed 12/15/17.
- Horlocker TT, Burton AW, Connis RT, et al. American Society of Anesthesiologists task force on neuraxial opioids. Practice guidelines for the prevention, detection, and management of respiratory depression associated with neuraxial opioid adminstration. Anesthesiology 2009;110:218–30.
- Jungquist CR, Correll DJ, Fleisher LA, et al. Avoiding adverse events secondary to opioid-induced respiratory depression: implications for nurse executives and patient safety. J Nurs Adm 2016;46:87–94.
- Niesters M, Mahajan RP, Aarts L, et al. High-inspired oxygen concentration further impairs opioid-induced respiratory depression. Br J Anaesth 2013;110:837–41.
- Curry JP, Lynn LA. Threshold Monitoring, Alarm fatigue, and the patterns of unexpected hospital death. APSF Newsletter 2011;26:32–5. https://dev2.apsf.org/newsletters/html/2011/fall/07_threshold.htm.
- Maddox RR, Williams CK. Clinical experience with capnography monitoring for pca patients. APSF Newsletter 2012; 26:47–50.
- Weininger S, Jaffe MB, Rausch T, et al. Capturing essential information to achieve safe interoperability. Anesth Analg 2017;124:83–94.
- Miller KM, Kim AY, Yaster M, et al. Long-term tolerability of capnography and respiratory inductance plethysmography for respiratory monitoring in pediatric patients treated with patient-controlled analgesia. Paediatric anaesthesia.2015;25:1054–9.
- Görges M, West NC, Christopher NA, et al. An ethnographic observational study to evaluate and optimize the use of respiratory acoustic monitoring in children receiving postoperative opioid infusions. Anesth Analg 2016;122:1132–40.
- van Loon K, Breteler MJM, van Wolfwinkel L, et al. Wireless non-invasive continuous respiratory monitoring with FMCW radar: a clinical validation study. J Clin Monit Comput 2016;30:797–805.
- Williams GW, George CA, Harvey BC, et al. A comparison of measurements of change in respiratory status in spontaneously breathing volunteers by the ExSpiron Noninvasive Respiratory Volume Monitor versus the Capnostream Capnometer.Anesth Analg 2017;124:120–6.
- Galvagno SM, Duke PG, Eversole DS, et al. Evaluation of respiratory volume monitoring (RVM) to detect respiratory compromise in advance of pulse oximetry and help minimize false desaturation alarms. J Trauma Acute Care Surg 2016;81:S162–70.


 Issue PDF
Issue PDF