Introducción
 La anemia es una condición que se observa con frecuencia en las salas de partos. Combinada con la posibilidad de pérdida masiva de sangre en el período de periparto, el control de la anemia en la madre es fundamental para mantener a las madres y a sus bebés a salvo. La anemia prenatal se ha asociado a resultados adversos para la madre y el recién nacido, incluyendo parto prematuro, aborto espontáneo, retraso del crecimiento, parto por cesárea e infección intrauterina.1,2 La anemia puerperal se ha asociado a depresión, cansancio y deterioro en la cognición.3
La anemia es una condición que se observa con frecuencia en las salas de partos. Combinada con la posibilidad de pérdida masiva de sangre en el período de periparto, el control de la anemia en la madre es fundamental para mantener a las madres y a sus bebés a salvo. La anemia prenatal se ha asociado a resultados adversos para la madre y el recién nacido, incluyendo parto prematuro, aborto espontáneo, retraso del crecimiento, parto por cesárea e infección intrauterina.1,2 La anemia puerperal se ha asociado a depresión, cansancio y deterioro en la cognición.3
La deficiencia de hierro es la causa más frecuente de anemia en el período de periparto. Las terapias de reemplazo de hierro se han estudiado de forma exhaustiva, y se ha mostrado regularmente que mejoran los índices hematológicos4 pero, hasta el momento, ningún estudio ha demostrado una mejora constante en los resultados clínicos de la madre o del recién nacido. Esto nos obliga a hacernos esta pregunta: ¿cómo podemos marcar una diferencia importante en el tratamiento y el control de la anemia en la madre para que mejoren los resultados clínicos? Como profesionales de la anestesia, ¿cómo podemos asociarnos con nuestros colegas obstetras para disminuir el impacto de la anemia en el parto? Aquí, destacamos nuestros conocimientos actuales sobre la anemia en la madre, su tratamiento, las estrategias de control y las futuras áreas de investigación.
Cómo aprovechar el centro perioperatorio
Los profesionales de la anestesia están bien equipados para preparar a los pacientes para cirugías programadas con mucha pérdida de sangre, y las directrices en el ámbito de la sociedad incluyen recomendaciones para el tratamiento de la anemia en el espectro de atención perioperatoria.5 Sin embargo, pocas de estas recomendaciones hacen referencia específicamente a la población de pacientes embarazadas. La consulta prenatal con un profesional de la anestesia se suele hacer si hay condiciones hematológicas, como trombocitopenia o coagulopatías hereditarias, pero raras veces en caso de anemia. Para el momento en el que una parturienta anémica recibe atención de un profesional de la anestesia, a menudo el período para el tratamiento ya ha terminado. Establecer asociaciones entre obstetras, hematólogos y profesionales de la anestesia podría ayudar a tratar el diagnóstico oportuno y el control de la anemia por deficiencia de hierro (IDA) en la madre.
Alcance del problema
La anemia es una de las condiciones médicas más frecuentes en el embarazo, ya que afecta a casi una de tres mujeres embarazadas en todo el mundo.6 La incidencia y el grado de anemia por deficiencia de hierro (IDA) varía considerablemente en el transcurso del embarazo y según la población, lo que refleja la compleja interacción de las deficiencias nutricionales preexistentes y la homeostasis de hierro a lo largo del embarazo. Por ejemplo, en países de ingresos bajos y medios, la IDA puede afectar hasta la mitad de las mujeres embarazadas, independientemente de la edad gestacional.7,8 Incluso en el mundo desarrollado, hay disparidades raciales importantes: en un estudio, las mujeres afroamericanas tuvieron más de tres veces el índice de IDA que las mujeres blancas no hispanas.9 La conexión entre la IDA y los malos resultados del embarazo no es difícil de imaginar: acompañan a la anemia en la madre aumentos de choques hemorrágicos, insuficiencia cardiovascular, transfusión en el período de periparto e índices más altos de infección.10-12 Además, las investigaciones nuevas están comenzando a mostrar que la IDA en el período de periparto afecta no solo a la madre, sino también al feto. En un importante estudio reciente de cohortes de más de medio millón de niños, se demostró una asociación entre la anemia en la madre y los trastornos del neurodesarrollo.13 Estos hallazgos demuestran la importancia de controlar esta condición frecuente.
Tratamiento de la anemia por deficiencia de hierro
El pilar del tratamiento de la IDA en el embarazo son los suplementos de hierro por vía oral. Los suplementos de hierro por vía oral son asequibles, se consiguen fácilmente, tienen requisitos de almacenamiento simples y tienen un historial de seguridad comprobado. Sin embargo, los suplementos de hierro por vía oral suelen estar limitados por sus efectos secundarios gastrointestinales, como náuseas, dispepsia o estreñimiento, que se pueden presentar en más de la mitad de las pacientes.14 En estudios que se han centrado en mejorar los parámetros hematológicos de la madre (p. ej., hemoglobina, ferritina), se han detectado pequeñas mejoras en estos valores con los suplementos de hierro por vía oral.4 Sin embargo, los estudios no han podido demostrar una mejora constante en otros resultados de la madre o del feto, como menos necesidad de transfusión, una mejor recuperación o un mayor peso al nacer.
Los motivos pueden ser variados. El diagnóstico de anemia por deficiencia de hierro se puede demorar en el embarazo: puede que no se haga un seguimiento del recuento en sangre completo (CBC) inicial que muestre anemia en la consulta del primer trimestre; y el diagnóstico puede tardar hasta que se puedan hacer estudios de hierro en una consulta posterior, que puede ser uno o dos meses más tarde. Es clínicamente factible que la intervención temprana tenga un impacto mayor en los resultados de la madre y del feto. Además, en general, los estudios en esta área han sido de menor escala y han carecido de una metodología coherente.15 Es posible que otros estudios a gran escala ayuden a determinar cuál es el beneficio clínico del tratamiento temprano para la deficiencia de hierro en la madre.
Seguridad del hierro intravenoso
El hierro intravenoso ha surgido como un tratamiento alternativo para las mujeres con IDA que son intolerantes a los suplementos por vía oral, tienen una respuesta insuficiente, requieren que se corrija rápidamente la deficiencia o tienen trastornos de absorción insuficiente. Con la llegada de compuestos más novedosos de hierro de menor peso molecular con dextrano y sin dextrano, las preocupaciones sobre la anafilaxia con las formulaciones de hierro parenterales anteriores han dado lugar a un historial de seguridad comprobado en el embarazo.15 Las reacciones adversas se presentan con menos frecuencia que con los suplementos de hierro por vía oral y tienden a ser más leves (p. ej., manchas en la piel, broncoespasmo transitorio).16 Sin embargo, dado que estas son formulaciones parenterales, requieren al menos una visita médica y son considerablemente más costosas que los suplementos por vía oral. Además, no hay directrices sobre si se debe monitorear la frecuencia cardíaca del feto en la infusión de estos compuestos, y hay pocos estudios sobre estos medicamentos en mujeres que informen del monitoreo de la frecuencia cardíaca del feto.17 Hay un solo estudio de caso que menciona la bradicardia grave del feto en la infusión de un producto de hierro intravenoso (ferric derisomaltose), que hizo que fuera necesario un parto por cesárea de emergencia.18 Aunque numerosos estudios han determinado la seguridad de estos compuestos, se debe trabajar más para definir protocolos que garanticen la seguridad de la madre y del feto durante la administración.
Nuestro papel
Los obstetras podrían usar la prueba de reflejo del hierro, desarrollada en la clínica de preanestesia19, para diagnosticar y tratar la IDA antes en el embarazo. Podrían remitir a las pacientes que necesiten hierro intravenoso a consulta de anemia perioperatoria, donde actualmente hay infraestructura clínica y de monitoreo. Se han observado disminuciones prometedoras en las transfusiones perioperatorias con el tratamiento de plazo ultracorto de pacientes anémicas con cirugía cardíaca.20 Adaptar estos tratamientos a las mujeres embarazadas puede ayudar a limitar las consecuencias de la anemia en el período de periparto. Muchas instituciones han comenzado a tratar a mujeres en consulta donde se administra hierro en el período perioperatorio, lo que da más oportunidades para que la investigación clínica evalúe la eficacia de este modo de atención.
El tratamiento de la anemia prenatal no siempre es exitoso, y puede haber hemorragia de forma imprevista en el período de periparto, incluso en pacientes sin anemia preexistente. Esto requiere que los profesionales de la anestesia y los obstetras tomen decisiones en equipo sobre cuándo es apropiado hacer una transfusión a una paciente en el período de periparto. En estudios a gran escala de pacientes no obstétricas, no se observaron beneficios (y un aumento en los daños) asociados a una estrategia de transfusión liberal.21 Se han observado hallazgos similares en pacientes en el período de periparto.22 Esto ha hecho que la ASA y la Asociación Americana de Bancos de Sangre hicieran recomendaciones a favor de las estrategias conservadoras de transfusión de sangre (es decir, umbral de transfusión de hemoglobina de <7 frente a <10).23,24 Sin embargo, hay límites para los enfoques basados en el umbral de transfusión. La hemorragia puerperal suele ocurrir rápidamente y requiere que un profesional de la anestesia considere los beneficios de la transfusión (es decir, una mejora en la perfusión) en relación con los posibles riesgos (p. ej., infección, sobrecarga circulatoria por transfusión [TACO], lesión pulmonar aguda producida por transfusión [TRALI]). Otras estrategias perioperatorias, como el uso de la recuperación de sangre25 y el tratamiento con antifibrinolíticos,26 pueden reducir aún más el índice de transfusiones en el período de periparto.
Combinar estas estrategias en programas integrales de administración de sangre a las pacientes puede ayudar a las instituciones a protocolizar el tratamiento para la anemia al inicio del embarazo, lo que puede reducir la cantidad de transfusiones de sangre innecesarias. Uno de esos programas incluyó guías clínicas para el diagnóstico, material educativo, protocolos de laboratorio y recetas de hierro estandarizadas (Figura 1).27 Después de su implementación, la tasa de pruebas de ferritina aumentó diez veces y la cantidad de transfusiones disminuyó un 50 %. Algunos programas similares han demostrado una disminución en los índices de anemia en el ingreso y una reducción en el índice de transfusiones.28,29 Es posible que estos y otros programas de este tipo ayuden a los proveedores a darse cuenta del potencial del tratamiento para la deficiencia de hierro prenatal para mejorar los resultados de la madre y del feto.
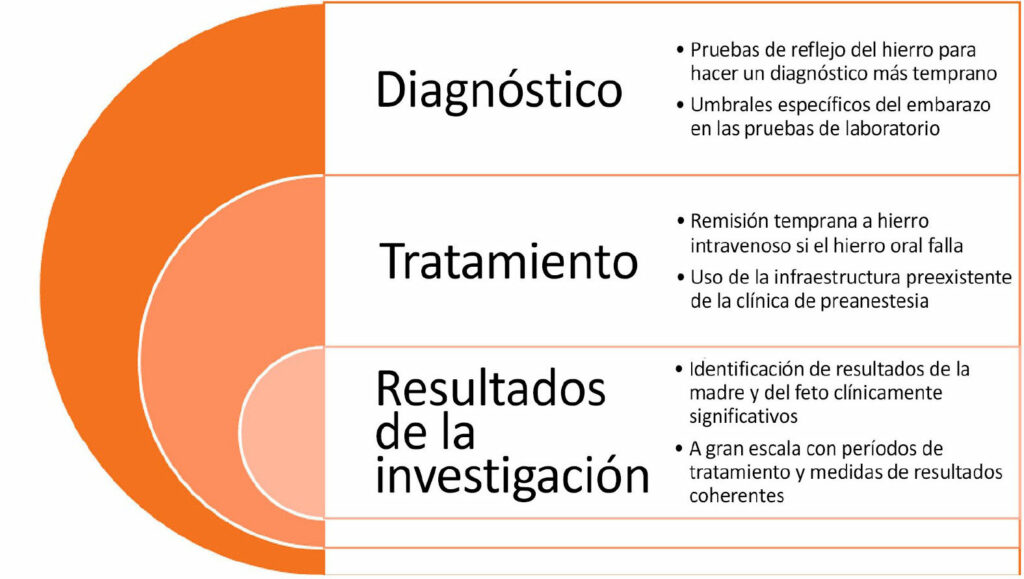
Figura 1: Oportunidades de mejora en el diagnóstico, tratamiento y estudio de la anemia por deficiencia de hierro en la madre.
Anemia puerperal
Aunque se ha estudiado relativamente poco, la anemia puerperal está vinculada a numerosos efectos adversos en la madre, incluyendo cansancio, depresión y deterioro en la cognición. No es de extrañar que la anemia prenatal y la hemorragia puerperal sean factores pronósticos significativos de la anemia puerperal.30 Y, a diferencia de la IDA prenatal, la IDA puerperal suele producirse de forma repentina, con una pérdida significativa de las reservas de hierro aproximadamente en el momento del parto. El tratamiento de la IDA puerperal con hierro oral está sujeto a los mismos problemas de cumplimiento y tolerancia que la terapia prenatal. Por este motivo, el tratamiento con hierro intravenoso se perfila como un tratamiento de primera línea para restaurar rápidamente el hierro perdido en el parto, y ya se ha mostrado que provoca un aumento más rápido y significativo de la hemoglobina en comparación con el tratamiento con hierro oral.3
La administración de hierro intravenoso puede ayudar a evitar parte de la morbilidad asociada a la transfusión de sangre, dada la evidencia de que una parte de las transfusiones puerperales de glóbulos rojos puede ser inapropiada.31,32 Concretamente, en un estudio reciente de ausencia de inferioridad, más de 500 mujeres con anemia puerperal no sintomática fueron asignadas al azar a la transfusión de glóbulos rojos o a la no intervención.22 Este estudio solo indicó puntuaciones de cansancio ligeramente inferiores en las mujeres que recibieron transfusiones. En el futuro, la comparación directa de la transfusión y el tratamiento con hierro intravenoso puede ayudar a determinar el tratamiento óptimo de las mujeres con IDA puerperal y minimizar las transfusiones de sangre innecesarias.
Conclusión
La IDA en el período de periparto sigue siendo un problema frecuente e importante vinculado a diversos resultados clínicos perjudiciales para las mujeres y sus bebés. Sin embargo, no se ha mostrado coherentemente que los suplementos de hierro mejoren estos resultados. Las oportunidades de colaboración entre los profesionales de la anestesia, los obstetras y los hematólogos son muchas, y aprovechar las herramientas del centro perioperatorio puede ser un medio para mejorar los resultados clínicos de la madre y del feto. Mientras tanto, tener conciencia de los problemas de seguridad de las consecuencias y del tratamiento de la IDA en el período de periparto es primordial para los profesionales de la anestesia responsables de la atención de estas pacientes.
Jack M. Peace, MD es profesor auxiliar en Temple University.
Jennifer M. Banayan, MD es profesora asociada en el Departamento de Anestesiología de Northwestern University Feinberg School of Medicine.
Jack Peace, MD no tiene conflictos de intereses. Jennifer Banayan, MD es editora del Boletín informativo de la APSF.
Referencias
- Prefumo F, Fichera A, Fratelli N, Sartori E. Fetal anemia: diagnosis and management. Best Pract Res Clin Obstet Gynaecol. 2019;58:2–14.
- Butwick AJ, McDonnell N. Antepartum and postpartum anemia: a narrative review. Int J Obstet Anesth. 2021:102985.
- Sultan P, Bampoe S, Shah R, et al. Oral vs intravenous iron therapy for postpartum anemia: a systematic review and meta-analysis. Am J Obstet Gynecol. 2019;221:19-29.e13.
- Abraha I, Bonacini MI, Montedori A, et al. Oral iron-based interventions for prevention of critical outcomes in pregnancy and postnatal care: an overview and update of systematic reviews. J Evid Based Med. 2019;12:155–166.
- Warner MA, Shore-Lesserson L, Shander A, et al. Perioperative anemia: prevention, diagnosis, and management throughout the spectrum of perioperative care. Anesth Analg. 2020;130:1364–1380.
- Stevens GA, Finucane MM, De-Regil LM, et al. Global, regional, and national trends in haemoglobin concentration and prevalence of total and severe anaemia in children and pregnant and non-pregnant women for 1995-2011: a systematic analysis of population-representative data. Lancet Glob Health. 2013;1:e16-25.
- Black RE, Victora CG, Walker SP, et al. Maternal and child undernutrition and overweight in low-income and middle-income countries. The Lancet. 2013;382:427–451.
- McLean E, Cogswell M, Egli I, et al. Worldwide prevalence of anaemia, WHO Vitamin and Mineral Nutrition Information System, 1993-2005. Public Health Nutr. 2009;12:444–454.
- Mohamed MA, Ahmad T, Macri C, Aly H. Racial disparities in maternal hemoglobin concentrations and pregnancy outcomes. J Perinat Med. 2012;40:141–149.
- Milman N. Anemia—still a major health problem in many parts of the world! Ann Hematol. 2011;90:369–377.
- VanderMeulen H, Strauss R, Lin Y, et al. The contribution of iron deficiency to the risk of peripartum transfusion: a retrospective case control study. BMC Pregnancy Childbirth. 2020;20:196.
- Drukker L, Hants Y, Farkash R, et al. Iron deficiency anemia at admission for labor and delivery is associated with an increased risk for cesarean section and adverse maternal and neonatal outcomes. Transfusion. 2015;55:2799–2806.
- Wiegersma AM, Dalman C, Lee BK, et al. Association of prenatal maternal anemia with neurodevelopmental disorders. JAMA Psychiatry. 2019;76:1294–1304.
- Cancelo-Hidalgo MJ, Castelo-Branco C, Palacios S, et al. Tolerability of different oral iron supplements: a systematic review. Curr Med Res Opin. 2013;29:291–303.
- Qassim A, Grivell RM, Henry A, et al. Intravenous or oral iron for treating iron deficiency anaemia during pregnancy: systematic review and meta-analysis. Med J Aust. 2019.
- Govindappagari S, Burwick RM. Treatment of iron deficiency anemia in pregnancy with intravenous versus oral iron: systematic review and meta-analysis. Am J Perinatol. 2019;36:366–376.
- Jose A, Mahey R, Sharma JB, et al. Comparison of ferric Carboxymaltose and iron sucrose complex for treatment of iron deficiency anemia in pregnancy-randomised controlled trial. BMC Pregnancy Childbirth. 2019;19:54.
- Woodward T, Kay T, Rucklidge M. Fetal bradycardia following maternal administration of low-molecular-weight intravenous iron. Int J Obstet Anesth. 2015;24:196–197.
- Okocha O, Dand H, Avram MJ, Sweitzer B. An effective and efficient testing protocol for diagnosing iron-deficiency anemia preoperatively. Anesthesiology. 2020;133:109–118.
- Spahn DR, Schoenrath F, Spahn GH, et al. Effect of ultra-short-term treatment of patients with iron deficiency or anaemia undergoing cardiac surgery: a prospective randomised trial. Lancet. 2019;393:2201–2212.
- Carson JL, Stanworth SJ, Roubinian N, et al. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst Rev. 2016;10:Cd002042.
- Prick BW, Jansen AJ, Steegers EA, et al. Transfusion policy after severe postpartum haemorrhage: a randomised non-inferiority trial. BJOG. 2014;121:1005–1014.
- Management ASoATFoPB. Practice guidelines for perioperative blood management: an updated report by the American Society of Anesthesiologists Task Force on Perioperative Blood Management. Anesthesiology. 2015;122:241–275.
- Carson JL, Guyatt G, Heddle NM, et al. Clinical practice guidelines from the AABB: red blood cell transfusion thresholds and storage. JAMA. 2016;316:2025–2035.
- Goucher H, Wong CA, Patel SK, Toledo P. Cell salvage in obstetrics. Anesth Analg. 2015;121:465–468.
- O’Brien KL, Shainker SA, Lockhart EL. Transfusion management of obstetric hemorrhage. Transfus Med Rev. 2018;32:249–255.
- Abdulrehman J, Lausman A, Tang GH, et al. Development and implementation of a quality improvement toolkit, iron deficiency in pregnancy with maternal iron optimization (IRON MOM): a before-and-after study. PLoS Med. 2019;16:e1002867.
- Flores CJ, Yong A, Knights E, et al. Maternity iron, anaemia and blood management in South Australia: a practice-based evidence for clinical practice improvement. Vox Sang. 2020;115:735–744.
- Guinn NR, Cooter ML, Maisonave Y, et al. How do I develop a process to effectively treat parturients with iron deficiency anemia? Transfusion. 2020;60:2476–2481.
- Butwick AJ, Walsh EM, Kuzniewicz M, et al. Patterns and predictors of severe postpartum anemia after Cesarean section. Transfusion. 2017;57:36–44.
- Butwick AJ, Aleshi P, Fontaine M, et al. Retrospective analysis of transfusion outcomes in pregnant patients at a tertiary obstetric center. Int J Obstet Anesth. 2009;18:302–308.
- Parker J, Thompson J, Stanworth S. A retrospective one-year single-centre survey of obstetric red cell transfusions. Int J Obstet Anesth. 2009;18:309–313.


 Issue PDF
Issue PDF