El fiasco de la gripe porcina
 En enero de 1976, un grupo de soldados sanos contrajeron una enfermedad respiratoria desconocida en Fort Dix, un centro de entrenamiento del Ejército de los Estados Unidos en Nueva Jersey. Varios fueron hospitalizados. Un recluta, que se negó a ser hospitalizado, murió. Se demostró que la causa fue el H1N1, la cepa de la gripe responsable de la pandemia de 1918. Se consideró el tipo más peligroso de gripe, pero, desde 1918, se limitó principalmente a las personas que trabajaban con cerdos. Por primera vez en 58 años, el H1N1 estaba claramente propagándose con rapidez mediante el contacto entre personas. Después de unas pocas semanas, 13 de cada 500 hombres jóvenes se enfermaron y 1 murió.
En enero de 1976, un grupo de soldados sanos contrajeron una enfermedad respiratoria desconocida en Fort Dix, un centro de entrenamiento del Ejército de los Estados Unidos en Nueva Jersey. Varios fueron hospitalizados. Un recluta, que se negó a ser hospitalizado, murió. Se demostró que la causa fue el H1N1, la cepa de la gripe responsable de la pandemia de 1918. Se consideró el tipo más peligroso de gripe, pero, desde 1918, se limitó principalmente a las personas que trabajaban con cerdos. Por primera vez en 58 años, el H1N1 estaba claramente propagándose con rapidez mediante el contacto entre personas. Después de unas pocas semanas, 13 de cada 500 hombres jóvenes se enfermaron y 1 murió.
Para los científicos de los Centros para el Control y la Prevención de Enfermedades (Centers for Disease Control and Prevention, CDC), fue como si hubiese llegado el apocalipsis por la gripe. Armados con una tecnología (vacunas) que no estaba disponible en 1918, o en las epidemias más pequeñas de gripe de 1957 y 1968, los CDC instaron a la vacunación masiva. El 24 de marzo de 1976, el presidente Gerald Ford, acompañado de los Dres. Sabin y Salk, creadores de la vacuna contra la poliomielitis, anunció:
“Me han informado de que hay un posibilidad muy real de que, si no tomamos medidas eficaces para combatirla, podría haber una epidemia de esta peligrosa enfermedad en el próximo otoño y verano aquí en Estados Unidos. Permítanme aclarar que en estos momentos nadie sabe exactamente qué tan grave podría ser esta amenaza. Sin embargo, no podemos arriesgar la salud de nuestra nación. En consecuencia, hoy anunciaré las siguientes medidas. Le pido al Congreso que se destinen USD 135 millones antes del receso de abril para la producción de vacunas suficientes para inocular a todos los hombres, mujeres y niños en los Estados Unidos”.1
Los ensayos de campo de la vacuna comenzaron en abril. La vacunación masiva comenzó el 1 de octubre de 1976. Once días más tarde, tres pacientes mayores de Pittsburgh murieron casi inmediatamente después de la vacunación. El Departamento de Salud del condado de Allegheny suspendió el programa de vacunación. En Minnesota, las autoridades de salud observaron varios casos del síndrome de Guillain-Barré. A esto le siguió un aumento de la incidencia de muertes por causas desconocidas y casos del síndrome de Guillain-Barré (una complicación de la gripe en sí y de otras vacunas contra la gripe).2 Cuando no aparecieron más casos de H1N1 en invierno, la relación riesgo/beneficio percibida pasó a ser totalmente de riesgo, y el programa de vacunación se dio por terminado en diciembre.
Se establecieron nuevos programas después de ese “fiasco de la gripe porcina” de 1976. Una gran ironía es que, probablemente, las personas vacunadas en 1976 hayan estado protegidas cuando llegaron a adultos mayores en la pandemia de H1N1 de 2009.3 El programa de vacunación contra la gripe porcina de 1976 también presagió muchos de los retos de comunicar los beneficios de la vacuna frente a la seguridad de la vacuna, que vemos con los programas de vacunación actuales.
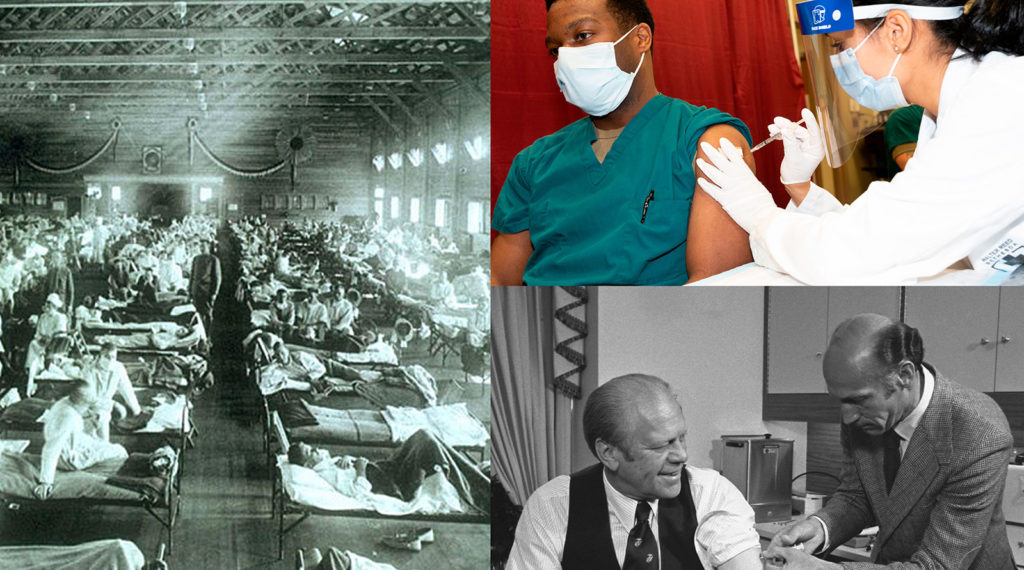
Izquierda: pandemia de gripe de 1918, Museo Nacional de Salud y Medicina (National Museum of Health and Medicine), Instituto de Patología de las Fuerzas Armadas (Armed Forces Institute of Pathology), Washington, DC, Estados Unidos. Derecha, arriba: El Dr. Isaiah Horton, capitán del ejército, recibe la vacuna contra el COVID-19, Secretaría de Defensa de los EE. UU. Derecha, abajo: el presidente de los EE. UU. Gerald Ford recibe la vacuna contra la gripe porcina; Gerald R. Ford Presidential Library.
Operación Warp Speed
A diferencia del fiasco de la gripe porcina de 1976, en el que no se observaron casos subsiguientes de H1N1 después del brote inicial en Fort Dix, al 5 de abril de 2021 había más de 130 millones de casos y 2,8 millones de muertes en todo el mundo (figura 1) debido al SARS-CoV-2. En Estados Unidos, 1 de cada 11 personas se ha infectado de SARS-CoV-2 y, aproximadamente, 1 de cada 600 estadounidenses ha muerto por COVID-19 (más de 540000 a marzo de 2021).
Proyección mundial al 5 de abril de 2021

Figura 1: Proyección mundial al 5 de abril de 2021.32
Source: Actualización diaria de COVID-19, usado con permiso del autor.
La epidemia de COVID ha concentrado la potencia científica del mundo como nunca antes. En los Estados Unidos, la “Operación Warp Speed” fue una asociación público-privada que se creó para darles apoyo gubernamental casi ilimitado a las compañías que estaban tratando de crear vacunas y otros tratamientos para el COVID-19. Se establecieron programas similares en Europa, India y China, con un éxito sin precedentes.
Según la Organización Mundial de la Salud, hay actualmente 82 vacunas en desarrollo clínico (tabla 1).4 Entre ellas, 13 están actualmente aprobadas en al menos 1 país.5 Todas las vacunas han demostrado tener eficacia. La única preocupación grave que ha surgido sobre la seguridad es la probabilidad extremadamente baja de que la vacuna de AstraZeneca provoque trombosis. Lo repito con énfasis: la única preocupación grave que ha surgido sobre la seguridad es la probabilidad extremadamente baja de que la vacuna de AstraZeneca provoque trombosis.
Tabla 1: Plataformas de vacunas en desarrollo.33
| Plataforma | Vacunas candidatas |
| Subunidad proteica | 28 |
| Vector viral (no replicativo) | 12 |
| ADN | 10 |
| Virus inactivado | 11 |
| ARN | 11 |
| Vector viral (replicativo) | 4 |
| Partícula similar al virus | 4 |
| Virus vivo atenuado | 2 |
| Vector viral replicativo + célula presentadora de antígenos | 2 |
| Vector viral no replicativo + célula presentadora de antígenos | 1 |
Las vacunas estimulan el sistema inmunitario. Precisamente, de eso se trata. Sabemos lo que se siente: fatiga, dolor de cabeza, mialgia, letargo y síntomas generalizados similares a los de la gripe. Estas respuestas no son causadas por el virus en sí. Es simplemente cómo nos sentimos cuando se activa el sistema inmunitario. Como las vacunas activan el sistema inmunitario, cualquiera de las vacunas puede hacernos sentir enfermos por un par de horas o quizá uno o dos días. Así como esperamos que el pinchazo duela un poco porque se introduce una aguja en el brazo, también debemos esperar sentirnos un poco afectados por un cuadro viral porque la vacuna activa el sistema inmunitario.
La pregunta de seguridad es qué otros efectos adversos podría producir la vacuna, además de hacernos sentir como si tuviésemos un cuadro viral.
Seguridad y eficacia de la vacuna
1. La BNT162b2 es una vacuna de ARNm desarrollada por Pfizer y BioNTech. Es la primera vacuna aprobada con la autorización de uso de emergencia (EUA)* en Estados Unidos. En un estudio de 43548 sujetos, la vacuna demostró tener una eficacia excepcional del 95 % y casi una eficacia del 100 % contra la enfermedad grave.6 Esto es similar a la eficacia de la vacuna MMRV.7 Solamente 1 paciente que recibió la vacuna (de más de 20000) tuvo COVID-19 grave. Los efectos adversos frecuentes estuvieron limitados a dolor en el lugar de la inyección y síntomas similares a los de la gripe. La seguridad y la eficacia demostradas en el estudio de fase 3 fueron reproducidas posteriormente cuando la vacuna se implementó a gran escala en Israel.8
Poco después de haberse iniciado el programa de vacunación BNT162b2, se observaron varios casos de anafilaxia.9 La evaluación más reciente es que el riesgo de anafilaxia es de aproximadamente 1 en 100000.10 Las vacunas de ARNm incorporan una nanopartícula de lípidos para facilitar la entrada del ARNm en la célula. Actualmente, se considera que la nanopartícula de lípidos es la responsable de las reacciones alérgicas poco frecuentes.11 El riesgo de anafilaxia se mitigó mediante el control inmediato de las personas hasta 30 minutos después de haber recibido la vacuna, lo que redujo el riesgo de anafilaxia a casi 0. Los CDC consideran que no ha habido muertes asociadas con la vacuna BNT162b2.12
2. La ARNm-1273 es una vacuna de ARNm desarrollada por Moderna. Es la segunda vacuna aprobada con la EUA en Estados Unidos. En el estudio de fase 3 de 30420 personas, la vacuna ARNm-1273 también demostró tener una eficacia excepcional del 94 %. Para poner esto en perspectiva, FDA estableció un límite del 50 % de eficacia como mínimo para la aprobación de la vacuna.13
Los riesgos de la vacuna ARNm-1273 de Moderna son idénticos a los de la vacuna de Pfizer/BioNTech.14 Esto es de esperar, ya que ambas vacunas usan las mismas nanopartículas de lípidos para facilitar el ingreso en la célula.15 El riesgo de anafilaxia es de aproximadamente 1 en 200000. No ha habido muertes ni lesiones graves. Por otra parte, las personas que reciban la vacuna ARNm-1273 deberán tener en cuenta que podrían sentirse levemente enfermas mientras el sistema inmunitario aumenta su actividad.
3. La AD26.COV2.S no es una vacuna de tipo ARNm, sino una vacuna de vector viral no replicativo desarrollada por Johnson & Johnson. Es la tercera vacuna aprobada con la EUA en Estados Unidos. El ensayo de fase 3 en 44325 adultos mostró una eficacia del 72 % en Estados Unidos, del 66 % en países de América Latina y del 57 % en Sudáfrica.16 Ninguna persona vacunada murió por COVID-19. Los datos sobre seguridad no fueron publicados en la bibliografía revisada por colegas. Sin embargo, el perfil de seguridad está bien descrito en el informe de la FDA17: “El análisis de seguridad hasta el 22 de enero de 2021 incluyó a 43783 participantes aleatorizados (1:1) mayores de 18 años, con una mediana de seguimiento de 2 meses. El análisis respaldó un perfil de seguridad favorable sin preocupaciones de seguridad específicas identificadas que pudieran impedir la emisión de una autorización de uso de emergencia”. No hubo casos de anafilaxia en el estudio, pero una persona tuvo una reacción de hipersensibilidad dos días después de haber recibido la vacuna, que no se clasificó como anafilaxia.*
4. La AZD1222, también conocida como ChAdOx1 nCoV-19, es una vacuna con vector de adenovirus desarrollada por una asociación de la Universidad de Oxford y AstraZeneca. Está aprobada en toda Europa, Asia y América del Sur. AstraZeneca completó recientemente un ensayo de fase 3 en Estados Unidos y ha anunciado planes para procurar la autorización de uso de emergencia en EE. UU.
La AZD1222 parece haber tenido problemas desde el principio. En la decisiva fase 3 del ensayo, hubo un error de dosis que ocasionó que una subpoblación de pacientes recibiera una dosis menor a la que debía recibir. Asombrosamente, esos pacientes tuvieron una mejor respuesta inmunitaria, pero no queda claro por qué ocurrió eso. En un análisis provisional, la vacuna tuvo una eficacia del 62 % en los pacientes que recibieron la dosis mayor según lo especificado en el protocolo y una eficacia del 90 % en los pacientes que recibieron la dosis menor.18 En el análisis final, la eficacia de la vacuna fue del 76 % después de una sola dosis estándar.19 Ningún paciente del grupo vacunado debió ser hospitalizado en los 21 días posteriores, y no hubo muertes por COVID en el grupo vacunado.
Los análisis de seguridad identificaron dos eventos adversos preocupantes: un caso de mielitis transversa y un caso de fiebre de 40 °C posterior a la vacunación sin motivo aparente. Ambos casos se resolvieron. Posteriormente, se informó de un caso de mielitis transversa, pero el investigador del centro determinó que no estaba relacionado.
Un artículo académico de Sudáfrica publicado en el New England Journal of Medicine después de la aprobación de la AZD1222 mostró que era ineficaz para la variante B.1.351, que pasó a ser la cepa predominante en Sudáfrica.20
En marzo de 2021, tres pacientes en Noruega sufrieron eventos de trombosis después de haber recibido la vacuna AZD1222, y un paciente murió. Noruega suspendió el uso de la vacuna durante el período de la investigación. Se informó de más eventos de trombosis en Europa, incluyendo 22 en el Reino Unido.21 También se informó de un caso en Australia.22 Lo inusual de estos casos es que están asociados con recuentos bajos de plaquetas, lo que sugiere un vínculo mecánico con la trombocitopenia inducida por heparina.23 Como respuesta, Dinamarca, Noruega, Islandia, Bulgaria, Irlanda, los Países Bajos, Alemania, Italia, Francia, España, Portugal, Suecia, Luxemburgo, Chipre y Letonia suspendieron el uso de la vacuna. Posteriormente, la Agencia Europea de Medicamentos, la Organización Mundial de la Salud24 y AstraZeneca25 determinaron que los casos de trombosis no estaban relacionados con la vacuna y recomendaron que se continuara con su uso.
El 22 de marzo de 2021, AstraZeneca anunció los resultados de un ensayo de fase 3 de 32449 sujetos en Estados Unidos.26 La vacuna tuvo una eficacia del 79 %, con una eficacia del 100 % en la prevención de la enfermedad grave. La Junta de Supervisión de Datos y Seguridad (Data and Safety Monitoring Board, DSMB) revisó los eventos de trombosis, incluyendo la trombosis de senos venosos cerebrales, y no halló pruebas de que el riesgo sea mayor. En el ensayo, no hubo ningún caso de trombosis de senos venosos cerebrales. Al día siguiente, la Junta de Supervisión de Datos y Seguridad (DSMB) emitió mediante el Instituto Nacional de Alergia y Enfermedades Infecciosas (National Institute of Allergy and Infectious Disease) una declaración que cuestionaba el anuncio de prensa de AstraZeneca manifestando que la DSMB había expresado una preocupación por el hecho de que AstraZeneca pudiera haber incluido información desactualizada de ese ensayo, que podría haber dado un panorama incompleto de los datos de eficacia.27
Como se mencionó, la AZD1222 parece haber tenido problemas desde el principio, a partir de que se cometió un error de dosis en el ensayo clínico. La controversia continuó con el hallazgo de que las dosis más bajas tenían una mayor eficacia, con preocupaciones por casos muy infrecuentes de mielitis transversa y trombosis, y, actualmente, con preocupaciones por la selección de los datos a conveniencia. Hay una excelente reseña de las complicaciones de la AZD1222 en Nature News.28 La Agencia Reguladora de Medicamentos y Productos de Atención Médica (Medicines and Healthcare products Regulatory Agency) del Reino Unido ha publicado directrices para diagnosticar y tratar la trombosis y la citopenia después de la vacunación.29
¿Aceptaría que me administraran la vacuna AZD1222? ¡Sí, por supuesto! La vacuna se aplicó a más de 17 millones de personas. Hubo aproximadamente 50 eventos de embolismo, una tasa de 3 por millón. La mortalidad de casos de COVID-19 es actualmente del 2,4 % aproximadamente, y más del 20 % de todos los pacientes que contraen COVID-19 tienen algún nivel de síntomas persistentes. Algunos cálculos simples: 17 millones × 75 % de umbral de inmunidad de rebaño × 2 % de tasa de letalidad de casos × 90 % de eficacia para prevenir la muerte = ~230000 vidas salvadas mediante la vacunación con la AZD1222.
5. 5.La Sputnik V es una combinación de dos vacunas de vector de adenovirus, desarrollada por el Instituto Gamaleya, de Rusia, y actualmente aprobada en Rusia y varios países de Asia, África, Medio Oriente y América del Sur. En el ensayo de fase 3 de 21977 sujetos, se halló una eficacia del 92 %.30 Después de 21 días, la vacuna fue 100 % eficaz contra la enfermedad grave y la muerte. No se informó de eventos adversos graves relacionados con la vacunación.
6. La Coronavac es una vacuna de SARS-CoV-2 inactivado que desarrolló Sinovac y que, actualmente, está aprobada en China y varios países de Asia y América del Sur. En la actualidad, los datos de los ensayos más grandes de fase 3 solo están disponibles en notas de prensa, pero estas sugieren que “la tasa de eficacia contra las enfermedades causadas por COVID-19 fue del 51 % en todos los casos, del 84 % en los casos que necesitaron tratamiento médico y del 100 % en los casos hospitalizados, graves y mortales”.31
7. La BBIBP-CorV es una vacuna de SARS-CoV-2 inactivado que desarrolló Sinopharm y que, actualmente, está aprobada en China y varios países de Asia, América del Sur y Medio Oriente. Parece haber aún menos datos sobre seguridad y eficacia que para la CoronaVac. Un resumen de Wikipedia sugirió una eficacia del 86 % en un estudio de Baréin y un 100 % de eficacia para prevenir la enfermedad grave. Estos datos no han sido publicados.
En resumen, las vacunas aprobadas actualmente parecen ser altamente eficaces para prevenir la infección y tienen una eficacia de casi 100 % para prevenir la enfermedad grave y la muerte. Los eventos adversos son excepcionalmente infrecuentes, como anafilaxia con las vacunas de ARNm y posiblemente casos muy infrecuentes de trombosis por la vacuna AZD1222 de AstraZeneca. Dado este perfil y el enorme costo social, económico y de salud de una pandemia sin mitigar, la relación riesgo-beneficio es asintóticamente de 1:0.
Steven Shafer, MD, es profesor de Anestesiología y Medicina Perioperatoria y del Dolor de la Stanford University.
El autor no tiene conflictos de intereses.
Referencias
- Neustadt RE, Fineberg HV. The swine flu affair: decision-making on a slippery disease. Washington (DC): National Academies Press (US); 1978.
- Sivadon-Tardy V, Orlikowski D, Porcher R, et al. Guillain-Barré syndrome and influenza virus infection. Clin Infect Dis. 2009;48:48–56.
- Xie H, Li X, Gao J, Lin Z, et al. Revisiting the 1976 “swine flu” vaccine clinical trials: cross-reactive hemagglutinin and neuraminidase antibodies and their role in protection against the 2009 H1N1 pandemic virus in mice. Clin Infect Dis. 2011;53:1179–87.
- World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed March 25, 2021.
- Regulatory Affairs Professionals Society. COVID-19 vaccine tracker. https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker. Accessed March 25, 2021.
- Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020;383:2603–2615.
- Henry O, Brzostek J, Czajka H, et al. One or two doses of live varicella virus-containing vaccines: efficacy, persistence of immune responses, and safety six years after administration in healthy children during their second year of life. Vaccine. 2018;36:381–387.
- Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA Covid-19 vaccine in a nationwide mass vaccination setting. N Engl J Med. 2021:NEJMoa2101765. doi: 10.1056/NEJMoa2101765. Epub ahead of print.
- CDC COVID-19 Response Team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Pfizer-BioNTech COVID-19 vaccine – United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep. 2021;70:46–51. doi: 10.15585/mmwr.mm7002e1.
- Turner PJ, Ansotegui IJ, Campbell DE, et al. COVID-19 vaccine-associated anaphylaxis: a statement of the World Allergy Organization Anaphylaxis Committee. World Allergy Organ J. 2021;14:100517.
- Moghimi SM. Allergic reactions and anaphylaxis to LNP-based COVID-19 vaccines. Mol Ther. 2021;29:898–900.
- Gee J, Marquez P, Su J, Calvert GM, et al. First month of COVID-19 vaccine safety monitoring – United States, December 14, 2020–January 13, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:283-288.
- Development and Licensure of Vaccines to Prevent COVID-19 – Department of Health and Human Services, FDA Center for Biologics Evaluation and Research. June 2020
- CDC COVID-19 Response Team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Moderna COVID-19 vaccine – United States, December 21, 2020–January 10, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:125–129.
- Cross R. Without these lipid shells, there would be no mRNA vaccines for COVID-19. Chemical & Engineering News. March 2021 (https://cen.acs.org/pharmaceuticals/drug-delivery/Without-lipid-shells-mRNA-vaccines/99/i8). Accessed March 25, 2021.
- Janssen Investigational COVID-19 Vaccine: interim analysis of Phase 3 clinical data released. National Institutes of Health News Release, January 29, 2021 (https://www.nih.gov/news-events/news-releases/janssen-investigational-covid-19-vaccine-interim-analysis-phase-3-clinical-data-released). Accessed March 25, 2021
- Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. FDA Briefing Document. https://www.fda.gov/media/146217/download. Accessed March 25, 2021.
- Voysey M, Clemens SAC, Madhi SA, et al. Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021 Jan 9;397(10269):99–111. doi: 10.1016/S0140-6736(20)32661-1. Epub 2020 Dec 8. Erratum in: Lancet. 2021 Jan 9;397(10269):98. PMID: 33306989; PMCID: PMC7723445.
- Voysey M, Clemens SAC, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet. 2021;397:881–891.
- Madhi SA, Baillie V, Cutland CL, et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 vaccine against the B.1.351 variant. N Engl J Med. 2021. doi: 10.1056/NEJMoa2102214. Epub ahead of print.
- Medicines & Healthcare products Regulatory Agency. Research and analysis: Coronavirus vaccine – weekly summary of Yellow Card reporting. https://www.gov.uk/government/publications/coronavirus-covid-19-vaccine-adverse-reactions/coronavirus-vaccine-summary-of-yellow-card-reporting. Accessed April 5, 2021.
- Reuters. Australia to continue AstraZeneca vaccination despite blood clotting case. https://www.reuters.com/article/us-health-coronavirus-australia/australia-to-continue-astrazeneca-vaccination-despite-blood-clotting-case-idUSKBN2BQ06B. Accessed April 5, 2021.
- Greinacher A, Thiele T, Warkentin TE, et al. A prothrombotic thrombocytopenic disorder resembling heparin-induced thrombocytopenia following Coronavirus-19 vaccination. Research Square Preprint Server. DOI: 10.21203/rs.3.rs-362354/v1.
- World Health Organization. Statement of the WHO Global Advisory Committee on Vaccine Safety (GACVS) COVID-19 subcommittee on safety signals related to the AstraZeneca COVID-19 vaccine. https://www.who.int/news/item/19-03-2021-statement-of-the-who-global-advisory-committee-on-vaccine-safety-(gacvs)-covid-19-subcommittee-on-safety-signals-related-to-the-astrazeneca-covid-19-vaccine.Accessed March 25, 2021.
- AstraZeneca. Update on the safety of COVID-19 Vaccine AstraZeneca. March 14, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/update-on-the-safety-of-covid-19-vaccine-astrazeneca.html. Accessed March 25, 2021.
- AstraZeneca. AZD1222 US Phase III trial met primary efficacy endpoint in preventing COVID-19 at interim analysis. March 22, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/astrazeneca-us-vaccine-trial-met-primary-endpoint.html. Accessed March 25, 2021.
- National Institues of Health. NIAID statement on AstraZeneca vaccine. https://www.nih.gov/news-events/news-releases/niaid-statement-astrazeneca-vaccine. Accessed March 25, 2021.
- Mallapaty S, Callaway E. What scientists do and don’t know about the Oxford-AstraZeneca COVID vaccine. March 24, 2021. https://www.nature.com/articles/d41586-021-00785-7. Accessed March 25, 2021.
- Guidance produced from the Expert Haematology Panel (EHP) focussed on syndrome of thrombosis and thrombocytopenia occurring after coronavirus vaccination. https://b-s-h.org.uk/media/19498/guidance-version-07-on-mngmt-of-thrombosis-with-thrombocytopenia-occurring-after-c-19-vaccine_20210330_.pdf. Accessed April 6, 2021.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397:671–681.
- Mallapaty, S. China COVID vaccine reports mixed results — what does that mean for the pandemic? Nature. January 15, 2021. https://www.nature.com/articles/d41586-021-00094-z. Accessed March 25, 2021.
- Source: Steve’s Daily COVID-19 update, distributed by the author daily except Sunday. The update is freely available. To be added to the distribution list just send me an e-mail ([email protected]). Case and death data are from the repository maintained by Johns Hopkins.
- World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. April 6, 2021. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed April 6, 2021.
*Desde que este artículo ingresó a producción, la vacuna de Johnson & Johnson parece estar asociada con el síndrome de trombosis y recuento bajo de plaquetas (ver https://espanol.cdc.gov/coronavirus/2019-ncov/vaccines/safety/JJUpdate.html). La incidencia parece ser de aproximadamente 1 caso por millón de dosis de la vacuna. Los CDC habían recomendado suspender la aplicación de la vacuna mientras se estudiaba la asociación y se identificaban los factores de riesgo. El 23 de abril de 2021, los CDC y la FDA levantaron la suspensión para administrar la vacuna de Johnson & Johnson y afirmaron que sus posibles beneficios superaban los riesgos.


 Issue PDF
Issue PDF