Introduction
L’administration de l’oxygénothérapie à haut débit (OHD) est une technique relativement récente, utilisée dans les services de soins intensifs et de réanimation, et de plus en plus au bloc opératoire. L’OHD s’avère utile en soins intensifs pour la gestion des patients présentant une insuffisance respiratoire aiguë avec hypoxémie pour éviter l’intubation ou pour aider après l’extubation. En anesthésie, le système OHD est parfois désigné par l’abréviation THRIVE (Transnasal Humidified Rapid-Insufflation Ventilatory Exchange). Une étude active est en cours pour définir des indications plus larges à l’OHD. Cette évaluation rapide décrira les mécanismes sous-jacents de l’OHD, son utilisation potentielle en anesthésie, les risques et les avantages de cette technique. Elle s’intéresse à l’utilisation de l’OHD chez les patients adultes (enfants exclus).
Mécanisme de l’OHD et composants
 Il existe une différence d’efficacité entre l’administration d’oxygène au moyen de canules nasales à bas débit et l’OHD. Lorsqu’il est administré de l’oxygène bas débit aux patients, les débits sont généralement compris entre 2 et 10 litres/minute (l/min). Les patients en respiration spontanée ont généralement un débit inspiratoire (DI) compris entre 20 et 40 l/min. Une fois que le DI est supérieur au débit d’O2 administré par la canule nasale, l’air ambiant est entraîné, diluant la FiO2. La concentration efficace d’oxygène administré (qui atteint les poumons) est généralement de 25 à 30 %, si un patient reçoit entre 2 et 4 l/min d’oxygène nasal.
Il existe une différence d’efficacité entre l’administration d’oxygène au moyen de canules nasales à bas débit et l’OHD. Lorsqu’il est administré de l’oxygène bas débit aux patients, les débits sont généralement compris entre 2 et 10 litres/minute (l/min). Les patients en respiration spontanée ont généralement un débit inspiratoire (DI) compris entre 20 et 40 l/min. Une fois que le DI est supérieur au débit d’O2 administré par la canule nasale, l’air ambiant est entraîné, diluant la FiO2. La concentration efficace d’oxygène administré (qui atteint les poumons) est généralement de 25 à 30 %, si un patient reçoit entre 2 et 4 l/min d’oxygène nasal.
En revanche, l’OHD utilise des débits d’oxygène compris entre 50 et 100 l/min. Avec cette technique, les débits élevés administrés via les canules nasales spécialement conçues sont supérieurs au DI du patient. Par conséquent, peu d’air ambiant est entraîné, permettant d’administrer une FiO2 élevée (95 à 100 %).
Les éléments qui composent un système OHD sont les suivants :
- Un distributeur électrique en oxygène/air haute pression (dans l’idéal, muni d’un mélangeur pour mélanger l’air au flux de gaz, afin de réduire la FiO2 si nécessaire)
- Un débitmètre adapté à des flux jusqu’à 100 l/min
- Un humidificateur pouvant humidifier complètement le mélange inspiré oxygène/air
- Une tubulure de gros calibre pour acheminer le gaz de l’alimentation à la canule nasale
- Des canules nasales spécialisées, de gros calibre, qui acheminent le mélange oxygène/air de la tubulure de gaz au nez du patient.
Effets physiologiques bénéfiques de l’OHD
L’OHD présente plusieurs effets bénéfiques qu’une canule nasale standard ne procure pas. À haut débit, le système OHD peut fournir une pression positive continue (continuous positive airway pressure, CPAP), élimine le CO2 de l’espace mort respiratoire et contribue au processus de diffusion de l’oxygène dans les alvéoles (remplaçant l’oxygène qui a été absorbé).1-3 En outre, il peut permettre de réduire le travail respiratoire et la résistance des voies respiratoires.4
L’OHD peut fournir de très hauts débits de gaz avec une FiO2 élevée ou des mélanges oxygène/air à des patients anesthésiés, sédatés ou réveillés. En fonction de la physiologie du patient, l’OHD peut être avantageuse pour la gestion de l’anesthésie, mais l’utilisation de l’OHD présente ses propres risques inhérents. Plusieurs applications de l’OHD sont décrites ci-dessous, chacune avec ses avantages et risques potentiels.
Applications cliniques des OHD avec leurs avantages et risques spécifiques:
- Amélioration de la préoxygénation avant l’induction de l’anesthésie générale (AG)
La préoxygénation à l’aide d’un système OHD peut être une bonne alternative à une préoxygénation standard, généralement réalisée avec une FiO2 de 1, dans le cadre d’une anesthésie en circuit fermé, avec un masque approprié.5,6 L’OHD est bien tolérée par les patients réveillés à un débit compris entre 30 et 40 l/min, fournit une préoxygénation efficace sans utiliser de masque et une CPAP continue, réduisant l’effet shunt. En outre, la préoxygénation avec l’OHD peut être poursuivie jusqu’à ce que le patient soit intubé.
- Apport d’une oxygénation continue et élimination du CO2 aux patients pendant l’intubation
L’utilisation d’un système OHD pendant le processus d’intubation peut permettre de prolonger le délai avant désaturation, grâce à l’oxygénation apnéique. Cette caractéristique est particulièrement intéressante pendant une intubation en séquence rapide (ISR), où le patient n’est pas ventilé au masque avant l’intubation.1 Un autre avantage de l’OHD pendant l’intubation est que l’accumulation de CO2 est limitée, en particulier pendant les 20 premières minutes,1 en raison de l’élimination du CO2 par le système OHD. Cet effet peut s’avérer particulièrement utile pour les intubations difficiles où la gestion des voies aériennes peut prendre plus de temps. Un aspect important de l’utilisation de l’OHD dont il faut tenir compte dans ce contexte est que le patient ne reçoit pas d’agent anesthésique volatil. Par conséquent, il faudra prévoir de prolonger l’anesthésie par voie intraveineuse pendant cette période. D’autre part, si la durée d’utilisation de l’OHD est prolongée (au-delà de 20 minutes), il faut recourir à une autre méthode de ventilation et d’élimination du CO2.1 Le délai de 20 minutes est une indication et variera en fonction de la physiologie du patient.
- Apport d’une oxygénation efficace pendant une intubation orale ou nasale avec fibres optiques ou vidéoscope chez un patient éveillé
Avec l’OHD, les patients éveillés subissant une intubation trachéale ont un meilleur apport en oxygène et bénéficient d’une CPAP alors que les voies respiratoires ne sont pas obstruées pour l’intubation. Étonnamment, la CPAP est effective même si la bouche reste ouverte, mais moins efficace qu’avec la bouche fermée.2 Il est possible de procéder à la préparation à une anesthésie topique et à une intubation nasale ultérieure avec fibres optiques en passant à côté de la canule nasale, si une intubation nasale est souhaitée. Toutefois, la canule nasale à côté de l’intubation doit être retirée avant de placer le tube orotrachéal. L’OHD peut également être avantageuse pour des patients éveillés dont les voies aériennes sont partiellement obstruées et qui subissent une intubation, en raison de sa capacité à réduire le travail respiratoire et la résistance des voies aériennes.
- Apport d’une assistance respiratoire après l’extubation
Les patients récemment extubés et nécessitant une assistance respiratoire partielle pour maintenir l’oxygénation/la ventilation peuvent bénéficier de l’OHD.2,3 L’OHD est une forme bien tolérée de CPAP (au niveau de 3 à 4 cm d’ H2O bouche ouverte) en plus de l’apport en oxygène. On ne recouvre pas la bouche du patient, qui peut ainsi parler tout en utilisant l’OHD. C’est vraisemblablement une technologie plus simple à installer et à utiliser que les nombreuses machines de CPAP/respirateurs avec masque. Toutefois, un risque identifiable est que le retrait fortuit de l’OHD (par un soignant présumant qu’il s’agit « d’oxygène nasale standard bas débit ») peut entraîner une hypoxémie aiguë et une insuffisance respiratoire.
- Oxygénation, réduction du travail respiratoire et participation à l’élimination du CO2 pendant les procédures chirurgicales
L’OHD peut être bénéfique pour les patients sédatés, voire anesthésiés (avec administration par intraveineuse), qui respirent spontanément et même avec des procédures nécessitant des périodes d’apnée.1,7 L’avantage est qu’il est possible de fournir une oxygénation et une ventilation adaptées, tout en laissant libres l’ouverture buccale, le larynx, le visage, le cou et d’autres parties hormis le nez pour procéder à une intervention chirurgicale. Cela pourrait concerner des cas où les voies aériennes sont partiellement obstruées, comme chez les patients subissant une trachéotomie.
Contre-indications et risques de l’OHD
Les contre-indications suggérées concernant l’OHD sont les suivantes:
- Une obstruction nasale partielle
- Une perturbation des voies aériennes, par ex. fracture du larynx, déchirure des muqueuses ou rupture de la trachée
- La nécessité d’un laser ou d’une diathermie (électrochirurgie) à proximité de l’administration de l’OHD, augmentant le risque d’embrasement. (Cela devient une contre-indication absolue dans de nombreuses situations associées à une FiO2 supérieure à 30 %.)
- Les infections pulmonaires contagieuses, comme la tuberculose
- L’infection nasale qui se transmet aux poumons avec l’utilisation d’une OHD est une contre-indication théorique. Toutefois, il n’existe à ce jour aucun élément de preuve démontrant la propagation pulmonaire avec l’OHD
- Les contre-indications à des concentrations élevées d’oxygène (par ex. une chimiothérapie antérieure à la bléomycine)
- L’incapacité à tolérer l’hypercapnie si l’OHD est utilisée en apnée prolongée (par ex. les patients atteints de drépanocytose, hypertension pulmonaire, hypertension intracrânienne et certaines formes de maladie cardiaque congénitale)
- Les enfants de moins de 16 ans. Des cas de syndromes de fuite d’air pulmonaire (c.-à-d. un pneumothorax) ont été signalés avec l’utilisation d’une OHD chez des enfants de moins de 16 ans.8 Il s’agissait d’évènements graves suggérant que des recherches et des conseils d’experts sont nécessaires pour déterminer l’utilisation de l’OHD en toute sécurité chez les enfants.
Les contre-indications relatives suggérées concernant l’OHD sont les suivantes:
- L’utilisation de solutions à base d’alcool associées à l’OHD, qui augmente le risque d’embrasement
- Les fractures connues ou soupçonnées au niveau de la base du crâne, une fuite du liquide céphalo-rachidien ou toute autre communication entre l’espace nasal et l’espace intracrânien
- Un pneumothorax grave qui n’a pas été traité au moyen d’un drain thoracique. L’effet de la CPAP peut conduire au développement du pneumothorax.9
- Une obstruction nasale complète
- Une épistaxis active ou une chirurgie endoscopique récente par voie endonasale (functional endoscopic sinus surgery, FESS).
L’application d’un masque hermétique par-dessus la canule de l’OHD pourrait créer trop de pression si le limiteur de pression de la machine d’anesthésie est fermé. C’est la raison pour laquelle les fabricants d’un système OHD ont conseillé de ne pas l’utiliser (le système Optiflow de Fisher and Paykel. Fisher and Paykel Healthcare Limited, Panmure, Auckland 1741, Nouvelle-Zélande).
Certains autres scénarios présentent des risques potentiels avec l’utilisation d’une OHD
Les auteurs n’argumentent pas en faveur ou contre l’utilisation de l’OHD pour ces scénarios. Nous présentons simplement certains des éléments les plus importants à prendre en compte dans l’analyse bénéfice risque de cette méthode, particulièrement importants car ils font déjà partie d’une pratique existante pour certains cliniciens.
- L’administration de l’OHD sous champ opératoire
Un risque spécifique, hormis ceux cités dans les contre-indications, est le risque potentiel d’embrasement lorsque l’OHD est administrée sous le champ opératoire. L’environnement riche en oxygène créé avec une OHD à FiO2 élevée ne requière qu’un déclencheur (comme un laser) pour s’enflammer, alors que les champs et les compresses peuvent servir de source potentielle de combustible.10 Ce risque avec l’oxygène a été montré dans des vidéos de simulation d’embrasement.11 Des facteurs importants qui ont une incidence sur le risque d’embrasement sont notamment la durée d’utilisation de l’OHD, des champs collants qui créent des obstacles au flux d’O2 le débit, la FiO2 de l’OHD et le renouvellement de l’air ambiant du bloc opératoire. Si l’OHD est utilisée dans ce contexte, il est impératif de prendre des précautions particulières face au risque d’incendie vis-à-vis de 3 éléments : le débit de l’OHD (et la FiO2), les sources de combustible et l’utilisation d’un dispositif d’allumage. Il est possible d’ajuster la FiO2 (l’abaissant à 21%) avec un mélangeur air/oxygène. Cela permettra de réduire le risque d’embrasement, tout en conservant certains des avantages de l’OHD pour la prise en charge du patient.
- La réalisation d’une trachéotomie d’urgence chez un patient éveillé dont les voies aériennes sont partiellement obstruées
La réalisation d’une trachéotomie d’urgence chez un patient éveillé peut être nécessaire si le patient présente une obstruction partielle grave des voies aériennes.12,13 L’OHD a été utilisée pour réaliser une trachéotomie d’urgence sur patient éveillé dans ce contexte, pouvant inclure le recours à la sédation.14 Les avantages de la technique de l’OHD avec sédation sont une meilleure oxygénation, un meilleur délai avant la désaturation, une réduction du travail respiratoire et potentiellement, un patient plus coopératif. Les risques spécifiques sont potentiellement la perte des voies aériennes et l’hypoxie. D’autre part, en fonction de la FiO2 utilisée avec l’OHD, le risque d’embrasement des voies aériennes peut être accru par rapport aux méthodes traditionnelles d’administration de l’oxygène.
- Chirurgie non urgente des voies aériennes
L’OHD peut être utile dans le cadre de chirurgies non urgentes, comme sur les voies aériennes (par ex. une micro-laryngoscopie), où l’on utilise souvent la sédation ou une AG par intraveineuse.1,6 Dans ce contexte, l’OHD peut être utilisée avec une ventilation spontanée. Si des périodes d’apnée sont nécessaires, il est possible d’utiliser la ventilation artificielle par insufflation manuelle par intermittence pour résoudre l’accumulation lente de CO2. Les avantages de l’OHD dans ce cadre sont une meilleure oxygénation (même avec une apnée prolongée), la réduction du travail respiratoire, voire une certaine élimination du CO2 par l’OHD. Le risque lié à l’utilisation de l’OHD pour une chirurgie non urgente des voies aériennes est la contamination par l’oxygène de l’espace chirurgical, augmentant le risque d’embrasement de l’espace et de la partie supérieure du corps du patient recouvert de champs opératoires. Le risque est généralement réel en cas d’utilisation de lasers ou de diathermie (ESU) (Figure 1). Les prestataires doivent comparer les avantages d’une meilleure oxygénation fournie par l’OHD aux risques d’embrasement. Les respirateurs modernes de jet-ventilation qui sont utilisés dans le cadre d’une micro-laryngoscopie15 sont dotés de caractéristiques spécifiques de sécurité pour faire baisser la FiO2 pendant l’utilisation d’un laser. Souvent, la jet-ventilation entraîne l’air ambiant, abaissant ainsi la FiO2. Toutefois, la FiO2 résultante est variable et par conséquent l’anesthésiste n’en connaît pas la valeur. Le risque de certains systèmes d’OHD est qu’ils soient configurés pour n’être utilisés qu’avec 100 % d’oxygène et qu’il n’existe aucun moyen de réduire la FiO2.Les fabricants d’une version du système OHD couramment utilisé, l’Optiflow de Fisher and Paykel (Fisher and Paykel Healthcare Limited, Panmure, Auckland 1741, Nouvelle-Zélande), indiquent clairement : « Pour éviter les brûlures… Ne pas utiliser le système à proximité d’une source quelconque d’allumage, notamment l’électrochirurgie, l’électrocautérisation ou des instruments de chirurgie au laser. L’exposition à l’oxygène augmente le risque d’embrasement. » L’avertissement médical est clair. En outre, cette information est susceptible d’être utilisée dans le cadre d’une quelconque procédure médico-légale si un feu survient pendant l’utilisation d’un système OHD. Cette mise en garde, cependant, n’a pas mis fin à l’utilisation des OHD dans la pratique courante et dans les études sur l’utilisation des OHD pendant une chirurgie du larynx au laser.7 Un cas de feu d’un bloc opératoire dans le cadre de l’utilisation d’une OHD a déjà été signalé.16
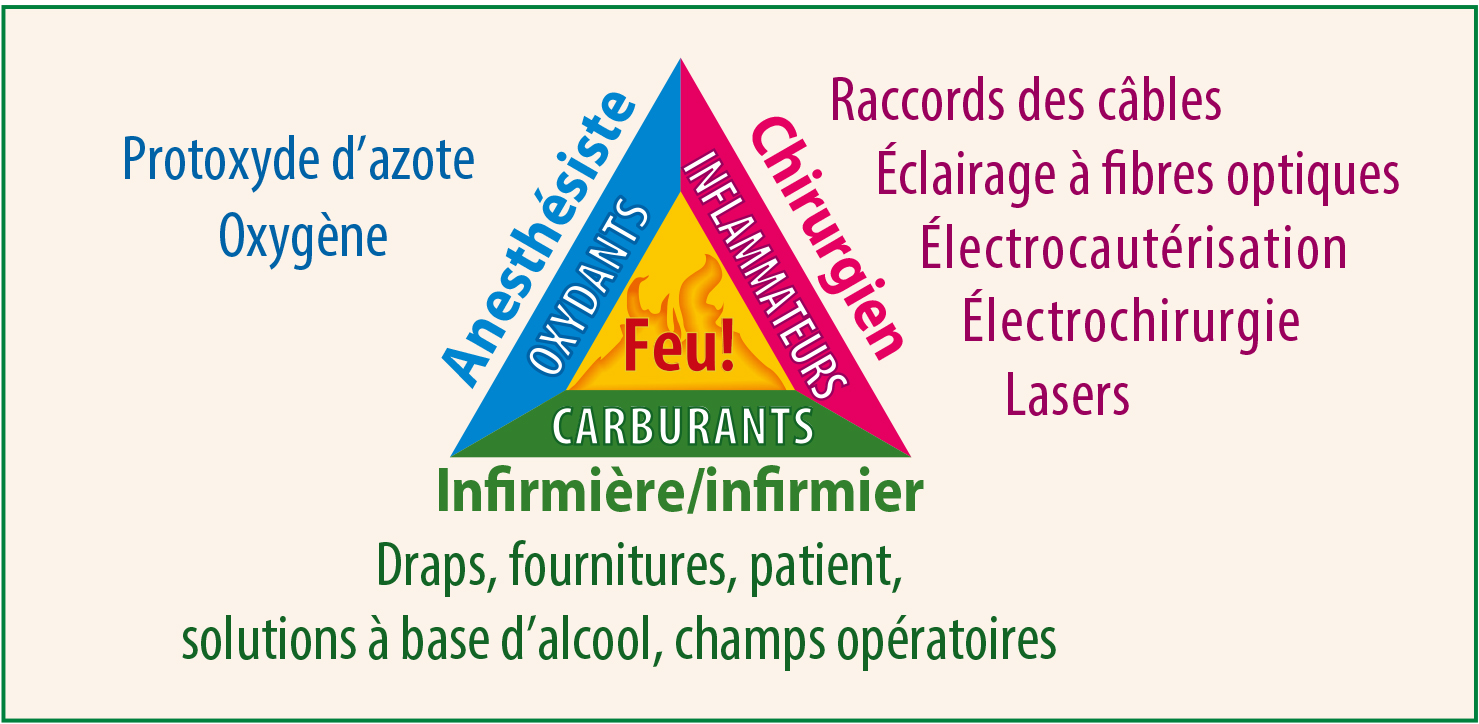
Figure 1. Illustre les trois éléments nécessaires pour allumer un feu : l’oxygène, le carburant et la source d’allumage.
Reproduction d’un article de l’APSF 2014. Affiche de prévention pour la sécurité incendie https://dev2.apsf.org/videos/or-fire-safety-video/ Consulté le 20 août 2018.
Conseils pour l’évaluation du risque d’embrasement lié à l’utilisation d’une OHD :
- Certains auteurs ont fait la distinction entre la survenue accidentelle de flammes et la propagation des flammes, celle-ci causant davantage de dégâts (brûlures).17 Le signalement de feux dans le cadre de l’utilisation d’un système OHD reste marginal et des études plus approfondies sont nécessaires.
- Nous n’avons pas d’éléments clairs permettant de déterminer la fréquence globale des incendies avec des interventions réalisées sous des différentes techniques de ventilation. Par conséquent, il est impossible de dresser une comparaison des risques d’embrasement.
- L’utilisation d’un mélangeur oxygène/air pour réduire la FiO2 avec un système OHD devrait contribuer à réduire le risque d’embrasement.
- L’OHD est une nouvelle technologie et le signalement de deux feux décrits à ce stade précoce de l’adoption pourrait laisser présumer que d’autres embrasements surviendront à l’avenir, au fur et à mesure que les systèmes OHD gagneront en popularité. *16 Les médecins devront faire preuve d’une extrême prudence pour réduire le risque d’embrasement.
- À ce jour, aucune atteinte à l’intégrité physique des patients n’a été signalée.
- La « pollution » par oxygène autour de la tête et du cou du patient pendant l’utilisation d’une OHD n’a pas fait l’objet d’études comparatives. Une vidéo de l’APSF qui s’intéresse au risque d’embrasement peropératoire indique qu’une concentration en oxygène supérieure à 30 % au niveau de la tête et du cou crée un plus grand risque d’embrasement, surtout pour les procédures réalisées dans cette zone.18
Considérations futures
Le système d’OHD sera de plus en plus utilisé au bloc opératoire. Un obstacle à cette tendance est le fait que pour pouvoir faire de l’OHD, l’appareil doit être apporté au bloc opératoire et monté à chaque utilisation. À l’avenir, il est possible que l’appareil d’OHD soit conçu de manière à pouvoir le raccorder directement en salle, pour en faciliter l’emploi. En raison des restrictions liées aux réglementations et à la fabrication, il est peu probable que de telles modifications soient disponibles à court terme. Les anesthésistes devraient encourager les fabricants à reconnaître ces problèmes et à s’employer à ajouter ce système à la nouvelle génération de machines.
Conclusions :
L’OHD est un système innovant d’assistance respiratoire, qui permet d’administrer une oxygénation à des concentrations variables, de réduire le travail respiratoire, de fournir une CPAP et de contribuer à l’élimination du CO2. L’OHD est est utile pour la préoxygénation en cas de risque d’intubation difficile, mais il s’accompagne de contre-indications relatives et absolues. Les risques potentiels d’atteinte à l’intégrité physique avec un OHD sont probablement sous-estimés. De nombreuses questions demeurent concernant les avantages et la sécurité dans des contextes cliniques spécifiques. Avant d’utiliser une OHD, il est fortement recommandé de dispenser une formation et des informations précises sur son utilisation.
Le Dr Cooper est consultant en anesthésie au Green Lane Dept. of Cardiothoracic and ORL Anaesthesia, Auckland City Hospital, Auckland, Nouvelle-Zélande.
Le Dr Griffiths est consultant en anesthésie au Green Lane Dept. of Cardiothoracic and ORL Anaesthesia, Auckland City Hospital, Auckland, Nouvelle-Zélande.
Le Dr Ehrenwerth est professeur émérite de la Yale University School of Medicine, New Haven, Connecticut, États-Unis.
Le Dr Cooper et le Dr Griffiths ont participé à des études cliniques sur l’OHD pour Fisher and Paykel Ltd, mais n’ont reçu aucun financement ni aucune autre contrepartie de la part de cette entité. Le Dr Ehrenwerth ne signale aucun conflit d’intérêt lié à cet article.
Documents de référence
- Patel A, Nouraei SA. Transnasal humidified rapid-insufflation ventilatory exchange (THRIVE): a physiological method of increasing apnea time in patients with difficult airways. Anaesthesia 2015;70:323–329.
- Groves N, Tobin A. High flow nasal oxygen generates positive airway pressure in adult volunteers. Aust Crit Care 2007;20:126–131.
- Parke R, McGuiness S, Eccleston M, et al. High-flow therapy delivers low level positive airway pressure. Br J Anaesth 2009;103:886–890.
- Dysart K, Miller TL, Wolfson MR, et al. Research in high flow therapy: Mechanisms of action. Resp Med 2009;103:1400–1405.
- Simon M, Wachs C, Braune S, et al. High-flow nasal cannula versus bag-valve-mask for preoxygenation before intubation in subjects with hypoxemic respiratory failure. Respir Care 2016;61:1160–1167.
- Nimmagadda U, Ramez Salem M, Crystal GJ. Preoxygenation: Physiological basis, benefits, and potential risks. Anesth Analg 2017;124:507–517.
- Booth AWG, Vidhani K, Lee PK, et al. SponTaneous Respiration using IntraVEnous anaesthesia and Hi-flow nasal oxygen (STRIVE Hi) maintains oxygenation and airway patency during management of the obstructed airway: an observational study. Br J Anaesth 2017;118:444–451.
- Hegde S, Prodhan P. Serious air leak syndrome complicating high-flow nasal cannula therapy: a report of 3 cases. Pediatrics 2013;131:e939–44.
- Wiersema Ubbo F. Noninvasive respiratory support. In: Sidebotham D, McKee A, Gillham M, Levy JH, editors. Cardiothoracic critical care. First ed. Philadelphia: Butterworth, Heinemann, Elsevier; 2007.
- Ehrenwerth J. Electrical and fire safety. In: Barash PG, Cullen BF, Stoelting RK, Cahalan MK, Stock MC, Ortega R, Sharar SR, and Holt NF, editors. Clinical anesthesia. 8th ed. Philadelphia: Wolters Kluwer; 2017.
- Cooper JO. Anesthesiology thermal injury. You Tube https://www.youtube.com/watch?v=FjA3dEyutt4. Accessed on July 1, 2018.
- Fang C, Friedman R, White PE, et al. Emergent awake tracheostomy—the five-year experience at an urban tertiary care center. Laryngoscope 2015;125:2476–9.
- Mason RA, Fielder CP. The obstructed airway in head and neck surgery. Anaesthesia 1999;54:625–628.
- Desai N, Fowler A. Use of transnasal humidified rapid-insufflation ventilatory exchange for emergent surgical tracheostomy: a case report. A A Case Rep 2017;9:268–270.
- Monsoon ventilator, Acutronic Medical Systems AG. Fabrik im Schiffli, 8816 Hirzel, Switzerland.
- Onwochei D, El-Boghdadly K, Oakley R, et al. Intra-oral ignition of monopolar diathermy during transnasal humidified rapid-insufflation ventilatory exchange (THRIVE). Anaesthesia 2017;72:781–783.
- Jones E, Overbey D, Chapman BC, et al. Operating Room Fires and Surgical Skin Preparation. J Am Coll Surg 2017;225:160–165.
- OR Fire Safety Video. https://dev2.apsf.org/videos/or-fire-safety-video/ Accessed on July 1, 2018.


 Issue PDF
Issue PDF