Le monitorage neuromusculaire quantitatif est le seul moyen fiable de confirmer une récupération adéquate après un bloc musculaire et d’éviter une faiblesse résiduelle postopératoire. Les anesthésistes doivent se familiariser avec les nouvelles technologies de monitorage afin de réduire les complications associées à une gestion insuffisante du bloc neuromusculaire.
Appel à la surveillance
Lorsque les patients deviennent hypertensifs au bloc opératoire, l’anesthésiste administre immédiatement le traitement nécessaire. Qu’il s’agisse de fluides intraveineux ou de médicaments vasoactifs, les cliniciens ont été formés à intervenir avec précision et à éviter une détérioration clinique. Comment les anesthésistes savent-ils que leur intervention a réussi ? Présument-ils que le bolus de phényléphrine était suffisant parce qu’ils connaissent la pharmacodynamique de ce médicament et qu’ils s’attendent à ce que tous les patients réagissent de manière prévisible ? Est-ce qu’ils palpent l’artère carotide à la suite d’un bolus de fluides intraveineux pour s’assurer qu’ils ont rétabli le volume intravasculaire et obtenu une stabilité hémodynamique ? Bien sûr que non. En fait, les anesthésistes font tout leur possible pour s’assurer qu’ils disposent d’appareils précis, tels qu’un brassard de tensiomètre de la bonne taille, voire un cathéter intra-artériel qui fournit des mesures quantitatives en temps réel de la tension artérielle. Ces professionnels s’attendent à ce que leur intervention ait l’effet souhaité, mais une vigilance innée les force à vérifier et à ne pas se fier à la pharmacodynamique prédictive ou à des évaluations subjectives, telles que la palpation du pouls.
Ce modèle de pratique doit être élargi à la gestion du bloc neuromusculaire. L’administration d’un antagoniste du bloc neuromusculaire, tel que le sugammadex ou la néostigmine, une attente de plusieurs minutes, suivie de l’extubation de la trachée d’un patient sans confirmer une récupération suffisante est une méthode semblable à l’administration de phényléphrine sans vérifier à nouveau la tension artérielle et confirmer que l’intervention a réussi. De même, la palpation de la réponse du pouce à une stimulation du train-de-quatre au moyen d’un neurostimulateur périphérique (NSP) et la détermination subjective d’une récupération suffisante constituent une pratique comparable à la palpation de l’artère carotide pendant l’administration du produit. Les anesthésistes s’appuient sur des technologies de pointe pour maintenir l’homéostase des patients et ne doivent pas exclure la gestion du bloc neuromusculaire de leur pratique.
La réticence parmi la communauté des anesthésistes à adopter un monitorage quantitatif (ou objectif) est un phénomène étrange qui a provoqué des publications bien spécifiques. Un sondage international de plus de 2500 anesthésistes a révélé de graves lacunes de connaissances à propos des principes fondamentaux de la gestion du bloc neuromusculaire. En effet, les personnes interrogées ont répondu correctement seulement à 57 % des questions. Encore plus inquiétant peut-être est le fait que 92 % des personnes qui ont répondu au sondage et qui ont donné de mauvaises réponses étaient malheureusement confiantes par rapport à celles-ci.1 On constate également une opinion croissante que le sugammadex élimine le besoin d’un monitorage quantitatif. Bien que cet antagoniste permette sans aucun doute une accélération de l’antagonisme du bloc neuromusculaire, à des degrés de bloc plus profonds, l’administration du sugammadex sans monitorage peut avoir pour conséquence une faiblesse résiduelle au moment de l’extubation chez 9,4 % des patients.2 Ces lacunes et cette confiance mal placée constituent indubitablement des obstacles, mais l’absence d’une formation uniforme a également été citée comme barrière au monitorage.3 Enfin, on constate historiquement une insuffisance de moniteurs neuromusculaires quantitatifs fiables et faciles d’emploi que les cliniciens intéressés pourraient utiliser.4
L’absence de monitorage quantitatif systématique est un problème qui persiste dans le monde entier, néanmoins une dynamique continue de s’instaurer, avec un intérêt grandissant pour ce sujet parmi les anesthésistes. Les panels d’experts réclament le monitorage systématique,5 alors que les associations d’anesthésistes ont mis en place des recommandations pour l’utilisation d’un monitorage quantitatif à chaque administration de curares.6-8 Le secteur a répondu avec de nouveaux moniteurs et des innovations qui devraient permettre l’amélioration de la sécurité des patients. Cet article passera en revue quelques-unes des technologies de pointe dont disposent actuellement les cliniciens souhaitant utiliser le monitorage neuromusculaire quantitatif.
Modalités de monitorage
L’utilisation d’un neurostimulateur périphérique (NSP) est qualitatif et même des anesthésistes expérimentés ne sont pas en mesure de détecter de manière fiable l’épuisement (fade) lorsque le rapport du train-de-quatre est supérieur à 0,4.9 En outre, les protocoles fondés sur les preuves qui intègrent l’administration ciblée de curares, l’antagonisme systématique du bloc neuromusculaire et « l’utilisation optimale » d’un neurostimulateur périphérique peuvent encore laisser 35 % des patients avec une faiblesse résiduelle.10 Le rôle limité du NSP doit être relégué à un dispositif utilisé uniquement si des moniteurs quantitatifs ne sont pas disponibles ou à un dispositif qui apporte des données qualitatives en attendant que les anesthésistes adoptent les moniteurs quantitatifs.5
Les moniteurs quantitatifs sont généralement classés en fonction des méthodes par lesquelles ils obtiennent des mesures objectives (aussi appelées leurs modalités de monitorage). Cependant, ces appareils peuvent aussi être classés selon qu’il s’agisse de moniteurs portatifs et indépendants ou de moniteurs intégrés à un dispositif de surveillance de l’anesthésie. Les moniteurs portatifs offrent la souplesse d’obtenir des mesures objectives en dehors du bloc opératoire. La faiblesse résiduelle postopératoire n’est certainement pas une menace spécifique à la sécurité des patients dans le cadre d’une intervention chirurgicale et les moniteurs portatifs permettent un diagnostic dans la salle de réveil ou dans le service de soins intensifs. Les moniteurs incorporés au dispositif de surveillance de l’anesthésie comportent des modules intégrés qui permettent une transmission transparente des mesures objectives au dossier médical électronique. La compréhension des besoins de votre pratique s’avèrera précieuse dans le choix d’une modalité de monitorage et la décision d’opter pour un moniteur portatif ou intégré.
La mécanomyographie
Avant sa commercialisation, chaque nouvel appareil est comparé à la mécanomyographie (MMG). Ce modèle d’excellence historique se caractérise par une installation fastidieuse, nécessitant un calibrage minutieux, car il permet d’obtenir des mesures objectives en mesurant la force de la contraction isométrique après la neurostimulation. Lors de l’interprétation des publications évaluées par les pairs sur les nouvelles technologies de monitorage quantitatif, le plus haut niveau de preuve résulte actuellement d’une comparaison directe avec la MMG.
L’accéléromyographie
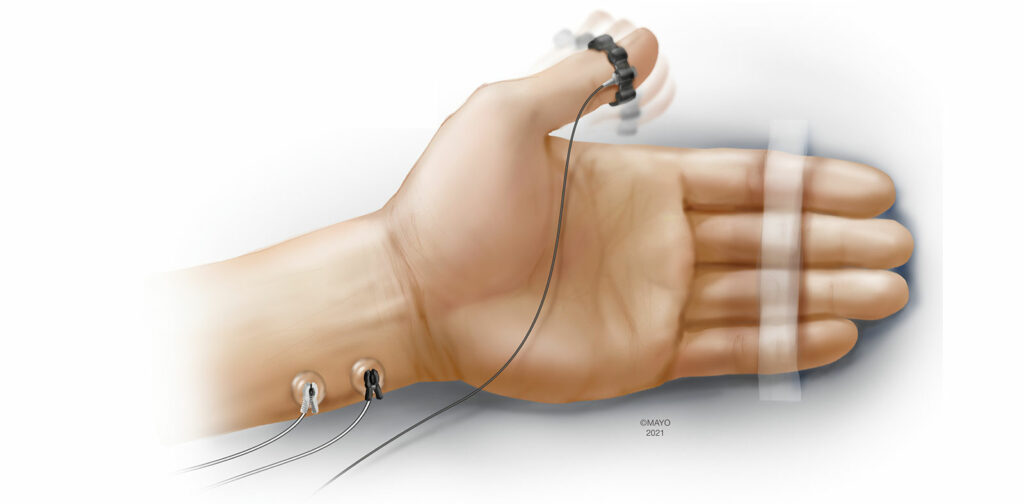
L’accéléromyographie (AMG) est l’une des formes de monitorage quantitatif les plus étudiées et les plus utilisées.4 Fondée sur la deuxième loi du mouvement de Newton (force = masse × accélération), l’AMG mesure de manière objective la réponse à la neurostimulation à l’aide d’un transducteur fixé sur le muscle concerné. Traditionnellement, les électrodes d’un électrocardiogramme (ECG) standard sont placées sur le nerf ulnaire et l’accélération du muscle adducteur du pouce est mesurée après la neurostimulation (Figure 1). Cette configuration ressemble fortement à l’utilisation d’un neurostimulateur périphérique sur la main, hormis le transducteur supplémentaire fixé au pouce. L’AMG est aussi utilisée sur le pied (muscle court fléchisseur de l’hallux) et sur le visage (orbiculaire de l’oeil/muscle corrugateur du sourcil). Bien que l’installation de l’AMG puisse être intuitive, cette modalité de monitorage comprend des mises en garde importantes. Le phénomène de « l’épuisement inversé » où le train-de-quatre de référence, sans paralysie, supérieur à 1,0 a été bien décrit dans le cadre du monitorage par AMG.11 Bien que les mécanismes exacts demeurent flous, l’épuisement inversé peut avoir des implications significatives quand il s’agit de savoir si un patient a atteint une récupération neuromusculaire adéquate avant d’extuber la trachée. La normalisation est un procédé qui place tous les rapports du train-de-quatre (TOFR) dans le contexte du train-de-quatre de référence (TOFR actuel/TOFR de référence) et peut tenir compte des TOFR de référence supérieurs à 1,0. Plutôt que de définir une récupération adéquate de la fonction neuromusculaire indiquée par un TOFR >0,9, une récupération adéquate est réellement obtenue lorsque le TOFR normalisé est supérieur à 0,9 en mesurant par AMG.
En outre, la normalisation diminue le biais par rapport à la MMG. L’utilisation d’un dispositif de précharge, qui stabilise le mouvement du pouce, et la réalisation du calibrage avant l’administration de curare, qui peut aussi renforcer la précision du monitorage par AMG, sont toutes les deux obligatoires pour réaliser des recherches dans ce domaine.12 Cependant, ces étapes supplémentaires ne sont pas impératives dans le cadre de soins cliniques. En revanche, la normalisation systématique est fortement conseillée pour éviter de surestimer le degré de récupération neuromusculaire à la fin de l’opération.
La mise en garde la plus importante à prendre en compte pour le monitorage par AMG est le fait que le muscle concerné (généralement le pouce) doit pouvoir effectuer librement des mouvements après la neurostimulation. La position du patient avec les bras placés le long du corps pendant une intervention chirurgicale peut avoir une incidence significative sur la capacité du clinicien à obtenir des mesures fiables avec l’AMG. D’autre part, le monitorage par AMG sur des patients éveillés peut s’avérer difficile en raison des artéfacts produits par les mouvements spontanés au site de monitorage.
Bien qu’il soit impératif que les cliniciens connaissent certaines nuances importantes avant la mise en œuvre du monitorage par AMG, les progrès récents réalisés dans le domaine de la modalité ont rendu l’AMG plus accessible. Des transducteurs tridimensionnels sont désormais intégrés aux appareils d’AMG les plus récents, permettant une meilleure quantification du mouvement complexe du pouce après neurostimulation. En outre, l’intégration de dispositifs de précharge dans les nouveaux appareils améliore la précision sans devoir obtenir et installer des équipements supplémentaires.13 D’autre part, des configurations sans fil des moniteurs AMG, qui utilisent la technologie Bluetooth pour transmettre les mesures quantitatives relevées au point de monitorage à un écran intégré à la machine d’anesthésie (communication personnelle), ont été développées. Les moniteurs AMG existent en version portative ou sous forme de modules pouvant être intégrés à la machine d’anesthésie.
La kinémyographie
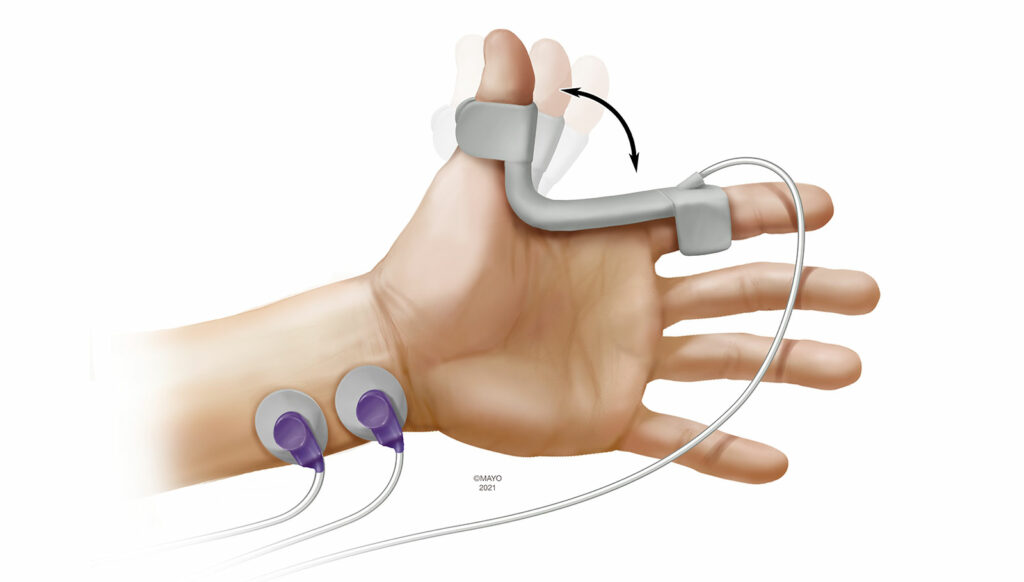
La kinémyographie (KMG) est une modalité de monitorage qui se rapproche de l’AMG. Pendant un monitorage par KMG, un capteur piézoélectrique est placé dans le creux entre le pouce et l’index (Figure 2). Après la stimulation du nerf ulnaire, le muscle adducteur du pouce se contracte et le capteur piézoélectrique se plie. Le degré de sa courbe est alors traduit en mesures objectives. Le capteur agit aussi comme dispositif de précharge et la KMG n’est pas soumise au phénomène d’épuisement inversé comme l’AMG. Des rapports antérieurs ont démontré de larges limites d’agrément entre la MMG et la KMG.14 Tout comme l’AMG, la KMG dépend aussi de la possibilité pour le pouce d’effectuer librement des mouvements et le positionnement du patient avec les bras serrés le long du corps peut empêcher cette utilisation. Les mouvements du patient pendant l’émergence peuvent aussi avoir une incidence sur le monitorage par KMG, ainsi que le repositionnement du capteur pendant la période peropératoire. Actuellement, le seul appareil fondé sur la KMG qui soit disponible est un module intégré à la machine d’anesthésie.
L’électromyographie
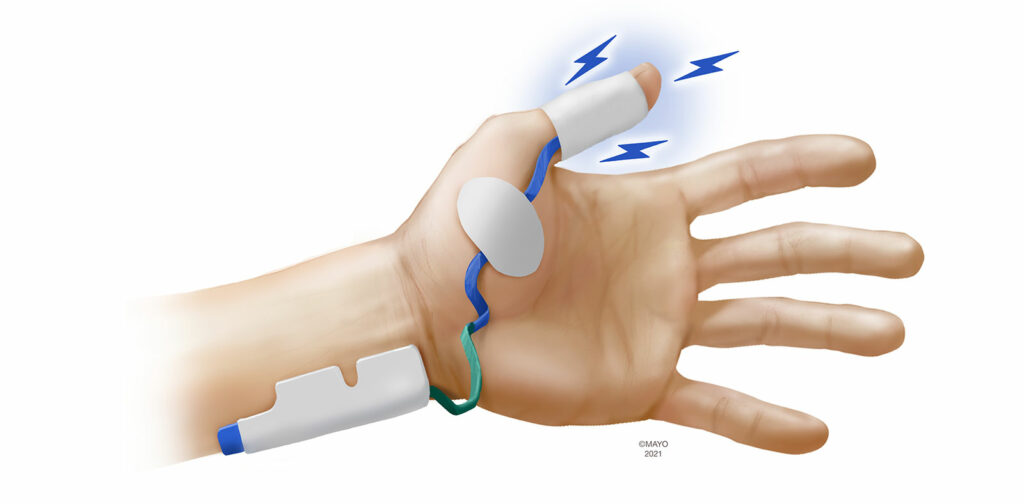
L’électromyographie (EMG) a été considérée par de nombreux experts comme la nouvelle règle d’or, en raison de son grand degré d’agrément avec la MMG15-17 et le fait que l’EMG procure des mesures quantitatives fiables lorsque les bras sont confinés pendant le positionnement chirurgical. L’EMG mesure les potentiels d’action globaux du muscle (PAM) dans l’unité neuromusculaire plutôt que le mouvement ou un quelconque substitut du mouvement. L’amplitude des PAS est directement proportionnelle au nombre de fibres musculaires activées (et donc à la force de contraction). L’EMG est sujette aux interférences créées par l’électrocautérisation et l’amplitude des PAM peut augmenter de 2 à 3 % pour chaque baisse de 1°C de la température cutanée.18
Les moniteurs EMG existent en version portative, manuelle ou intégrée à la machine d’anesthésie. La plupart des fabricants utilisent des électrodes propriétaires pour stimuler et mesurer les PAM qui sont placés sur la main. Parce que le monitorage par EMG n’est pas interrompu lorsque les bras du patient sont positionnés le long de son corps l’utilisation d’un site de mesure alternatif est moins importante bien que le monitorage au pied ait été décrit comme une option si aucune des deux mains n’est disponible.19 Pour un monitorage à la main, trois groupes musculaires ont été utilisés pour mesurer les MPA après la stimulation du nerf ulnaire. Comme pour l’AMG et la KMG, des électrodes de détection peuvent être placées sur le muscle adducteur du pouce (Figure 3). Le premier interosseux dorsal, situé dans l’espace entre le pouce et l’index, peut également être monitoré. Enfin, le muscle adducteur du petit doigt (auriculaire) est innervé par le nerf ulnaire et est un point de monitorage adapté à l’EMG. Bien qu’il s’agisse de la modalité de monitorage la plus ancienne, l’EMG suscite de plus en plus d’intérêt, comme le démontre la commercialisation de plusieurs nouveaux moniteurs à base d’EMG.
Monitorage par brassard
Un développement récent a permis d’intégrer le monitorage objectif au brassard d’un tensiomètre.20 Aussi appelé la technique du brassard modifié, le monitorage par brassard semble s’inspirer de la compressomyographie, une modalité de monitorage désormais abandonnée qui avait donné des premiers résultats prometteurs.21 Dans le monitorage par brassard, celui-ci est gonflé à environ 60 mmHg, puis des électrodes à l’intérieur du brassard assurent la neurostimulation. Des changements de pression sont détectés, suivis d’une contraction musculaire et ces changements de pression sont utilisés pour fournir aux cliniciens des données objectives sur le degré de bloc neuromusculaire. Les premières études ont montré que le monitorage du haut du bras peut présenter des propriétés neuromusculaires différentes des muscles distaux de la main et que le monitorage par brassard ne remplace pas nécessairement le monitorage par EMG ou AMG à la main.22 Bien que la technologie du monitorage par brassard puisse sembler intéressante, car elle permet de surveiller deux paramètres importants (la tension artérielle et le degré de bloc neuromusculaire), il faut procéder à d’autres recherches pour définir sa répétabilité et sa reproductibilité dans le cadre de divers scénarios cliniques.
La mise en œuvre du monitorage dans votre pratique clinique
Des obstacles se dressent sur l’implémentation de ces changements importants de pratique, en particulier lorsque de nombreux anesthésistes feignent de connaitre le problème persistant de la curarisation résiduelle postopératoire. La décision de changer votre pratique et d’y intégrer le monitorage peut être intimidante, car elle demande de sortir de votre zone de confort, de donner plus de votre temps et d’apprendre une nouvelle technique. Le fait qu’un tel changement puisse avoir un impact sur le flux de travail et l’efficacité pourra susciter des inquiétudes. Heureusement, il a été démontré que l’utilisation des moniteurs quantitatifs ajoute seulement 19 secondes d’effort au début d’un cas.23 Une fois que la décision a été prise de mettre en œuvre le monitorage, la décision sur la modalité peut aussi sembler insurmontable. Indubitablement, la compréhension de la culture de votre pratique est essentielle, comme le décrit Todd et al., lorsque ce groupe a mis en place le monitorage par EMG dans l’ensemble du service, après avoir observé qu’un nombre inacceptable de patients souffrait de détresse respiratoire en salle de réveil.24
La familiarisation avec les technologies de monitorage émergentes sera certainement un avantage pour améliorer la probabilité de la réussite de la mise en œuvre et du changement de pratique. Le moniteur ou la modalité spécifique est seulement une partie du changement, car la décision de changer de pratique est beaucoup plus importante et est très souvent beaucoup plus difficile. Ce changement impliquera sans aucun doute un supplément de travail, cependant nous devons à nos patients de leur faire bénéficier de soins d’avant-garde.
J. Ross Renew, MD, FASA, FASE est actuellement professeur assistant dans le Service d’anesthésie et médecine périopératoire de la Mayo Clinic de Jacksonville, Floride.
Il a reçu un financement pour ses recherches, notamment de Merck & Co, dont l’intégralité a été transmise à Mayo Clinic.
Documents de référence
- Naguib M, Brull SJ, Hunter JM, et al. Anesthesiologists’ overconfidence in their perceived knowledge of neuromuscular monitoring and its relevance to all aspects of medical practice: an international survey. Anesth Analg. 2019;128:1118–1126.
- Kotake Y, Ochiai R, Suzuki T, et al. Reversal with sugammadex in the absence of monitoring did not preclude residual neuromuscular block. Anesth Analg. 2013;117:345–351.
- Thomsen JLD, Marty AP, Wakatsuki S, et al. Barriers and aids to routine neuromuscular monitoring and consistent reversal practice—a qualitative study. Acta Anaesthesiol Scand. 2020;64:1089–1099.
- Soderstrom CM, Eskildsen KZ, Gatke MR, Staehr-Rye AK. Objective neuromuscular monitoring of neuromuscular blockade in Denmark: an online-based survey of current practice. Acta Anaesthesiol Scand. 2017;61:619–626.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018;127:71–80.
- Lucas DN, Russell R, Bamber JH, Elton CD. Recommendations for standards of monitoring during anaesthesia and recovery 2021. Anaesthesia. 2021 Jun 18. doi: 10.1111/anae.15528.
- Dobson G, Chow L, Filteau L, et al. Guidelines to the practice of anesthesia—revised edition 2020. Can J Anaesth. 2019;64:75–91.
- Indications of neuromuscular blockade in anaesthesia. Short text. Ann Fr Anesth Reanim. 2000;19 2:352s–355s.
- Viby-Mogensen J, Jensen NH, Engbaek J, et al. Tactile and visual evaluation of the response to train-of-four nerve stimulation. Anesthesiology. 1985;63:440–443.
- Thilen SR, Ng IC, Cain KC, Treggiari MM, Bhananker SM. Management of rocuronium neuromuscular block using a protocol for qualitative monitoring and reversal with neostigmine. Br J Anaesth. 2018;121:367–377.
- Claudius C, Skovgaard LT, Viby-Mogensen J. Is the performance of acceleromyography improved with preload and normalization? A comparison with mechanomyography. Anesthesiology. 2009;110:1261–70.
- Fuchs-Buder T, Claudius C, Skovgaard LT, et al. Good clinical research practice in pharmacodynamic studies of neuromuscular blocking agents II: the Stockholm revision. Acta Anaesthesiol Scand. 2007;51:789–808.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during Recovery of Neuromuscular Function. Anesthesiology. 2018;129:880–888.
- Motamed C, Kirov K, Combes X, Duvaldestin P. Comparison between the Datex-Ohmeda M-NMT module and a force-displacement transducer for monitoring neuromuscular blockade. Eur J Anaesthesiol. 2003;20:467–469.
- Engbaek J, Ostergaard D, Viby-Mogensen J, Skovgaard LT. Clinical recovery and train-of-four ratio measured mechanically and electromyographically following atracurium. Anesthesiology. 1989;71:391–395.
- Kopman AF. The relationship of evoked electromyographic and mechanical responses following atracurium in humans. Anesthesiology. 1985;63:208–211.
- Harper NJ, Bradshaw EG, Healy TE. Evoked electromyographic and mechanical responses of the adductor pollicis compared during the onset of neuromuscular blockade by atracurium or alcuronium, and during antagonism by neostigmine. Br J Anaesth. 1986;58:1278–1284.
- Engbaek J. Monitoring of neuromuscular transmission by electromyography during anaesthesia. A comparison with mechanomyography in cat and man. Dan Med Bull. 1996;43:301–316.
- Kern SE, Johnson JO, Orr JA, Westenskow DR. Clinical analysis of the flexor hallucis brevis as an alternative site for monitoring neuromuscular block from mivacurium. J Clin Anesth. 1997;9:383–387.
- Veiga Ruiz G, Garcia Cayuela J, Orozco Montes J, et al. Monitoring intraoperative neuromuscular blockade and blood pressure with one device (TOF-Cuff): a comparative study with mechanomyography and invasive blood pressure. Rev Esp Anestesiol Reanim. 2017;64:560–567.
- Dahaba AA, Bornemann H, Holst B, Wilfinger G, Metzler H. Comparison of a new neuromuscular transmission monitor compressomyograph with mechanomyograph. Br J Anaesth. 2008;100:344–350.
- Krijtenburg P, Honing G, Martini C, et al. Comparison of the TOF-Cuff® monitor with electromyography and acceleromyography during recovery from neuromuscular block. Br J Anaesth. 2019;122:e22–e24.
- Renew JR, Hex K, Johnson P, et al. Ease of application of various neuromuscular devices for routine monitoring. Anesth Analg. 2021;132:1421–1428.
- Todd MM, Hindman BJ, King BJ. The implementation of quantitative electromyographic neuromuscular monitoring in an academic anesthesia department. Anesth Analg. 2014;119:323–331.


 Issue PDF
Issue PDF