Veja o artigo original no link a seguir: https://dev2.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/
O gerenciamento intraoperatório cuidadoso do bloqueio neuromuscular pode otimizar a recuperação do paciente e melhorar os resultados pós-operatórios. Quatro artigos importantes do Boletim da APSF de fevereiro de 2016 descreviam por que o bloqueio neuromuscular residual pós-operatório (BNMR) era um problema importante de segurança do paciente e como a dosagem, a monitorização e a reversão adequadas dos agentes de bloqueio neuromuscular poderiam reduzir a incidência dessa complicação após a anestesia e a cirurgia.
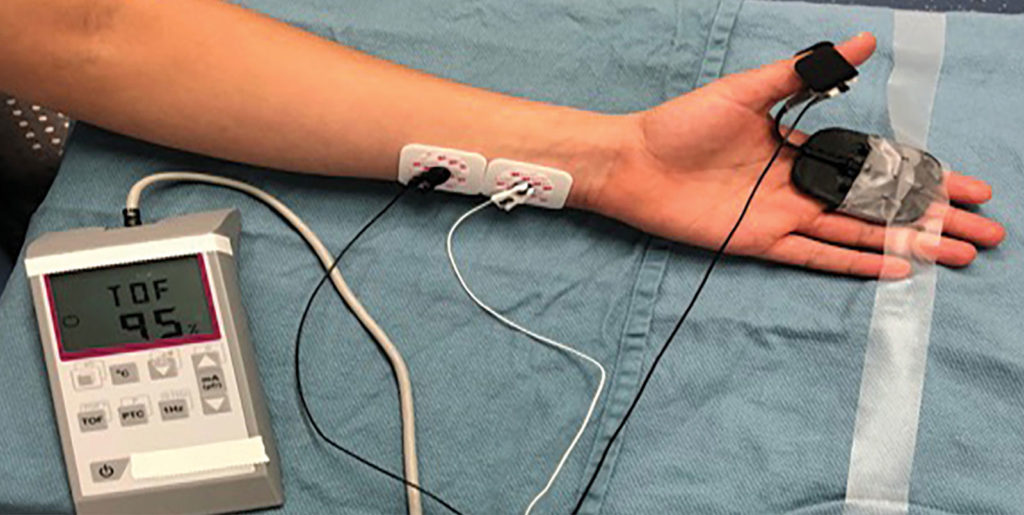
No primeiro artigo, Robert Stoelting, MD, resumia as opiniões da APSF sobre o uso da monitorização qualitativa (estimulador de nervo periférico) e da monitorização quantitativa (dispositivos que medem objetivamente a função muscular e exibem os resultados) no período perioperatório (Figura 1).1 A APSF recomendava que todos os pacientes que recebiam relaxante muscular deveriam ser monitorizados pelo menos qualitativamente e, de preferência, quantitativamente para avaliar os requisitos dos agentes de reversão e a adequação da função neuromuscular antes da extubação traqueal. As publicações foram revisadas, e constatou-se que o BNMR era um problema extremamente pouco valorizado e que ocorria em até 40% dos pacientes. Os pacientes com índices de sequência de quatro estímulos (TOF) < 0,9 (limiar da recuperação neuromuscular adequada) corriam risco de apresentar diversos resultados adversos, como hipoxemia, obstrução das vias aéreas, função faríngea prejudicada e maior risco de aspiração, demora para receber alta da SRPA, complicações pulmonares no pós-operatório e necessidade de reintubação. Embora as evidências tenham documentado claramente que a monitorização quantitativa poderia reduzir consideravelmente o risco de BNMR, esses dispositivos não eram aplicados com frequência na prática clínica. Os possíveis motivos de os profissionais terem demorado para adotar a monitorização quantitativa incluíam a crença equivocada de que o BNMR era um problema pouco comum, a indisponibilidade de dispositivos simples e fáceis de usar e a dependência excessiva dos indicadores insensíveis da recuperação neuromuscular (levantamento da cabeça por 5 segundos e estímulo de TOF sem desmaio). Robert Stoelting concluiu declarando que as associações profissionais norte-americanas de anestesia deveriam divulgar recomendações de que a monitorização neuromuscular (qualitativa e, idealmente, quantitativa) deveria ser utilizada sempre que relaxantes musculares fossem administrados.
No segundo artigo, os pesquisadores do The Massachusetts General Hospital, Boston, Massachusetts relataram uma iniciativa embasada em evidências que foi instituída no hospital para reduzir a incidência de BNMR.2 Essa iniciativa continha quatro componentes: implantação de um programa educacional, distribuição de um suporte cognitivo, divulgação de feedback sobre o progresso do departamento e a adoção de um requisito de documentação de TOF para recebimento do bônus de incentivo trimestral de melhoria da qualidade do departamento. As apresentações em todo o departamento forneceram informações sobre a incidência do BNMR e os resultados clínicos associados. O suporte cognitivo, que era um guia de dosagem de neostigmina baseada no TOF, foi distribuído para todos os membros do departamento. Por último, os bônus trimestrais de melhoria da qualidade estavam associados à taxa da documentação do número de contrações (contagem de TOF) dentro de 15 minutos a partir da administração de neostigmina. Essa iniciativa foi um exemplo de uma abordagem interdisciplinar integrada para promover a adoção constante das práticas recomendadas relacionadas ao gerenciamento neuromuscular, instituídas a fim de reduzir o BNMR e aumentar a segurança do paciente.
O terceiro artigo analisou o desenvolvimento e o histórico normativo do sugamadex nos Estados Unidos.3 Anton Bom, MD, do Neuromuscular Research Group da Organon Newhouse na Escócia, determinou que as ciclodextrinas modificadas se ligariam aos relaxantes musculares esteroidais. O primeiro estudo em humanos com esse novo agente foi realizado e publicado em 2005, e o sugamadex foi aprovado pelas agências regulatórias na União Europeia em 2008. Ao mesmo tempo nos Estados Unidos, a FDA emitiu uma carta de não homologação devido às preocupações com possíveis reações anafiláticas, além dos possíveis efeitos do medicamento na coagulação e no intervalo QT do ECG. Após realizar mais estudos e enviar documentos adicionais à FDA, o sugamadex foi aprovado em 16 de dezembro de 2015.
No 4º artigo, Karl Hammermeister, MD, e seus colegas revisaram brevemente as publicações que analisavam o impacto das estratégias de gerenciamento neuromuscular nos resultados pós-operatórios.4 Uma antiga investigação em grande escala por Beecher and Todd (1954) demonstrou que a mortalidade no pós-operatório era seis vezes mais alta em pacientes que receberam relaxantes musculares do que no grupo que não recebeu esses agentes.5 Hammermeister et al. observaram que havia apenas alguns estudos publicados comparando os resultados nos pacientes que receberam agentes de reversão versus os que não receberam agentes. Em um grande ensaio clínico realizado por Debaene et al., o risco do BNMR foi analisado nos pacientes que receberam uma única dose de um relaxante muscular para intubação sem agente de reversão. Os pesquisadores relataram que após duas ou mais horas desde a administração do relaxante muscular, 37% dos pacientes apresentaram razão de TOF < 0,9.6 A análise concluía afirmando que havia um consenso nas publicações de que o BNMR era comum e estava associado a um risco aumentado de resultados negativos, principalmente respiratórios. Além disso, a monitorização neuromuscular e a reversão adequada com neostigmina apresentou alta variação entre os anestesiologistas, e essas práticas com certeza representaram a alta incidência de BNMR.
O que sabemos sobre o manejo neuromuscular e os resultados pós-operatórios?
Desde a edição de fevereiro de 2016 do Boletim da APSF, inúmeros estudos clínicos foram publicados, analisando a incidência do BNMR nas práticas clínicas, as complicações associadas ao BNMR, o impacto das estratégias de reversão no resultados após a cirurgia e o desenvolvimento de novos monitores quantitativos.
Incidência de BNMR
As pesquisas continuaram documentando uma alta incidência de BNMR nas práticas de anestesia no mundo inteiro. O estudo RECITE-US mediu as razões de TOF em 255 pacientes que passaram por cirurgia abdominal nos Estados Unidos.7 Os pesquisadores observaram que a maioria dos pacientes (64,7%) apresentava razões de TOF < 0,9 no momento da extubação traqueal apesar da reversão do rocurônio com neostigmina e do uso da estimulação qualitativa do nervo periférico. Achados similares foram observados nos ensaios do RECITE realizados no Canadá8 e na China.9 Esses achados sugerem que o BNMR continua sendo uma complicação anestésica comum quando a monitorização quantitativa e o sugamadex não são usados.
Complicações associadas ao BNMR
Pacientes com razões de TOF < 0,9 na SRPA correm um risco maior de apresentarem resultados respiratórios negativos. Um grande estudo multicêntrico realizado na Espanha relatou que os pacientes com razões de TOF < 0,9 na SRPA corriam mais risco de apresentarem eventos respiratórios pós-operatórios negativos (razão de probabilidade [RP] de 2,57) e tinham uma incidência maior de reintubação.10 Outra pesquisa determinou que o indicador independente mais importante dos eventos respiratórios adversos durante o início da recuperação da anestesia e cirurgia era o BNMR (RP 6,4).11 Um estudo de coorte retrospectivo, que avaliou o impacto do BNMR nas taxas de internação na UTI, nos custos hospitalares e na duração da internação no hospital, informou que os pacientes com razões de TOF < 0,9 tinham um risco três vezes maior de serem internados na UTI do que os pacientes com razões de TOF ≥ 0,9.12
Efeito das estratégias de reversão nos resultados pós-operatórios
A não reversão do bloqueio neuromuscular pode elevar o risco de complicações pulmonares pós-operatórias. Em um grande estudo com banco de dados, Bulka et al. observaram que os pacientes que não receberam um agente de reversão apresentavam um risco 2,3 vezes maior de pneumonia pós-operatória do que os que receberam neostigmina.13 Em uma pesquisa similar com 11.355 pacientes cirúrgicos, a incidência de complicações respiratórias pós-operatórias (definidas como falha no desmame, pneumonia ou reintubação) foi bem maior nos pacientes que não foram revertidos em relação aos que receberam neostigmina.14 Uma terceira pesquisa com banco de dados determinou que os pacientes que não foram revertidos (versus a reversão com neostigmina) tiveram maior incidência de complicações graves (6,05% vs. 1,7%), necessidade de reintubação (4,6% vs. 0,8%) e internações não planejadas na UTI (3,2% vs. 0,8%).15
Estudos recentes documentaram que o sugamadex pode reduzir consideravelmente o risco de BNMR e afetar positivamente os resultados decorrentes de BNMR. Oh et al. coletaram dados retrospectivos de 1.479 pacientes que passaram por cirurgia abdominal e cujo bloqueio neuromuscular foi revertido com neostigmina ou sugamadex.16 Os pacientes do grupo do sugamadex apresentaram uma taxa de reinternação não planejada em 30 dias 34% menor, internação hospitalar 20% mais curta e redução de 24% nas despesas hospitalares. Um estudo prospectivo observacional (558 pacientes) relatou que complicações respiratórias graves (pneumonia ou atelectasia) ocorreram em 1,1% dos pacientes revertidos com sugamadex, versus 7,2% a 9,7% de todos os pacientes não revertidos ou revertidos com neostigmina.17 A monitorização neuromuscular foi usada apenas em aproximadamente 30% dos pacientes de cada grupo, o que pode ter explicado a falta de benefícios observada na reversão com neostigmina (a neostigmina é ineficaz se administrada em um nível de bloqueio mais profundo). Um grande estudo multicêntrico observacional de coortes correspondentes analisou o efeito da escolha do agente de reversão (neostigmina ou sugamadex) em complicações pulmonares pós-operatórias graves (pneumonia, insuficiência respiratória ou outras complicações pulmonares).18 No estudo, 22.856 pacientes que receberam sugamadex foram comparados com 22.856 pacientes que receberam neostigmina. Os pesquisadores observaram que a administração de sugamadex foi associada a uma redução de 30% no risco de complicações pulmonares, redução de 47% no risco de pneumonia e redução de 55% no risco de insuficiência respiratória. Em oposição a essas pesquisas, um grande estudo multicêntrico observacional (POPULAR) não concluiu que a administração de agentes de reversão estava associada ao risco reduzido de complicações pulmonares pós-operatórias.19 Além disso, não foram observados resultados pulmonares melhores nos pacientes que receberam sugamadex em comparação aos que receberam neostigmina. No entanto, várias cartas ao editor foram publicadas posteriormente e expuseram as preocupações relacionadas ao estudo, que incluíam as limitações inerentes a vários estudos observacionais, como falta de padronização de gerenciamento anestésico, ventilatório ou de fluidos; gerenciamento inadequado da monitorização e reversão do bloqueio neuromuscular; e uma incapacidade de supervisionar possíveis violações de protocolo ou outros fatores que geravam parcialidade.
Novos monitores quantitativos
Uma declaração de consenso recente sobre o uso da monitorização perioperatória recomendou que os monitores quantitativos devem ser usados sempre que um relaxante muscular não despolarizante tiver sido administrado.20 Contudo, para que os monitores objetivos sejam aceitos amplamente pelas práticas clínicas, são necessárias melhorias no design dos dispositivos para que a função não seja afetada pela posição da mão do paciente, os monitores devem se autocalibrar e fornecer resultados confiáveis e repetíveis e os tempos de configuração do monitor devem ser mínimos.16 Diferentemente da tecnologia da primeira geração, os monitores quantitativos desenvolvidos recentemente parecem atender à maioria desses critérios. A tecnologia tridimensional de aceleromiografia (AMG) foi incorporada recentemente aos monitores quantitativos desenvolvidos para o uso intraoperatório de rotina. Observou-se uma boa interação entre o TOF-Watch SX com calibração e aplicação de pré-carga (“padrão ouro” clínico) e um monitor tridimensional de aceleromiografia não calibrado durante todas as etapas da recuperação neuromuscular.21 Os dispositivos eletromiográficos (EMG) portáteis também foram desenvolvidos e aprovados recentemente para uso durante o atendimento clínico de rotina. Os dados da razão da sequência de quatro estímulos podem ser obtidos rapidamente após colocar uma fita de eletrodo na mão e conectar a fita a um cabo. Os monitores EMG fornecem dados quantitativos precisos sem precisar imobilizar o músculo analisado, aplicar a pré-carga ou movimentar o dedão livremente (os braços podem ficar dos lados).20 Entretanto, são necessários mais estudos para avaliar a precisão e a confiabilidade desses novos monitores quantitativos nas práticas clínicas.
Conclusões
Apesar dos avanços na farmacologia e na tecnologia ao longo do tempo, o BNMR continua ocorrendo com frequência nas práticas clínicas, mantendo praticamente a mesma taxa durante quatro décadas. Esses artigos importantes publicados em fevereiro de 2016 no Boletim da APSF ajudaram a conscientizar os profissionais sobre esse problema importante de segurança do paciente e prepararam o terreno para outras pesquisas e melhorias no atendimento clínico. Com o uso crescente de sugamadex (com dosagem adequada conforme a monitorização neuromuscular) e a monitorização quantitativa pelas equipes de cuidados anestésicos, é provável que o risco de os pacientes apresentarem complicações devido ao BNMR seja reduzido na próxima década.
Glenn Murphy, MD, é professor clínico na University of Chicago no Departamento de Anestesia e Medicina Intensiva e Diretor de Pesquisa Clínica no Departamento de Anestesiologia, Medicina Intensiva e Medicina da Dor no NorthShore University HealthSystem.
Atualmente, o Dr. Murphy é porta-voz da Merck.
Referências
- Stoelting RK. Monitoring of neuromuscular blockade: what would you expect if you were the patient? APSF Newsletter. 2016;30:45,47. https://dev2.apsf.org/article/monitoring-of-neuromuscular-blockade-what-would-you-expect-if-you-were-the-patient/ Accessed August 25, 2020.
- van Pelt M, Chitilian HV, Eikermann M. Multi-faceted initiative designed to improve safety of neuromuscular blockade. APSF Newsletter. 2016;30:51–52. https://dev2.apsf.org/article/multi-faceted-initiative-designed-to-improve-safety-of-neuromuscular-blockade/ Accessed August 25, 2020.
- Murphy GS. The development and regulatory history of sugammadex in the United States. APSF Newsletter. 2016; 53–54. https://dev2.apsf.org/article/the-development-and-regulatory-history-of-sugammadex-in-the-united-states/ Accessed August 25, 2020.
- Hammermeister KC, Bronsert M, Richman JS, Hensderson WG. Residual neuromuscular blockade (RNB), reversal, and perioperative outcomes. APSF Newsletter. 2016;30:74-75. https://dev2.apsf.org/article/residual-neuromuscular-blockade-nmb-reversal-and-perioperative-outcomes/ Accessed August 28,2020.
- Beecher HK, Todd DP. A Study of deaths associated with anesthesia and surgery. 1954. Int Anesthesiol Clin. 2007;45:1–6.
- Debaene B, Plaud B, Dilly M-P, et al. Residual paralysis in the PACU after a single intubating dose of nondepolarizing muscle relaxant with an intermediate duration of action. Anesthesiology. 2003;98:1042–1048.
- Saager L, Maiese EM, Bash LD, et al. Incidence, risk factors, and consequences of residual neuromuscular block in the United States: The prospective, observational, multicenter RECITE-US study. J Clin Anesth. 2019;55:33–41.
- Fortier LP, McKeen D, Turner K, et al. The RECITE Study: a Canadian prospective, multicenter study of the incidence and severity of residual neuromuscurlar blockade. Anesth Analg. 2015;121:366–72.
- Yu B, Ouyang B, Ge S, et al. RECITE–China Investigators. Incidence of postoperative residual neuromuscular blockade after general anesthesia: a prospective, multicenter, anesthetist-blind, observational study. Curr Med Res Opin. 2016;32:1–9.
- Errando CL, Garutti I, Mazzinari G, et al. Residual neuromuscular blockade in the postanesthesia care unit: observational cross-sectional study of a multicenter cohort. Minerva Anestesiol. 2016;82:1267–1277.
- Xará D, Santos A, Abelha F. Adverse respiratory events in the post-anesthesia care unit. Arch Bronconeumol. 2015;51:69–75.
- Grabitz SD, Rajaratnam N, Chhagani K, et al. The effects of postoperative residual neuromuscular blockade on hospital costs and intensive care unit admission: a population-based cohort study. Anesth Analg. 2019;128:1129–1136.
- Bulka CM, Terekhov MA, Martin BJ, et al. Nondepolarizing neuromuscular blocking agents, reversal, and risk of postoperative pneumonia. Anesthesiology. 2016;125:647–55.
- Bronsert MR, Henderson WG, Monk TG, et al. Intermediate-acting nondepolarizing neuromuscular blocking agents and risk of postoperative 30-day morbidity and mortality, and long-term survival. Anesth Analg. 2017;124:1476–1483.
- Belcher AW, Leung S, Cohen B, et al. Incidence of complications in the post-anesthesia care unit and associated healthcare utilization in patients undergoing non-cardiac surgery requiring neuromuscular blockade 2005–2013: a single center study. J Clin Anesth. 2017;43:33–38.
- Oh TK, Oh AY, Ryu JH, et al. Retrospective analysis of 30-day unplanned readmission after major with reversal by sugammadex or neostigmine. Br J Anaesth. 2019;122:370–378.
- Martinez-Ubieto J, Ortega-Lucea S, Pascual-Bellosta A, et al. Prospective study of residual neuromuscular block and postoperative respiratory complications in patients reversed with neostigmine versus sugammadex. Minerva Anestesiol. 2016;82:735–742.
- Kheterpal S, Vaughn MT, Dubovoy TZ, et al. Sugammadex versus neostigmine for reversal of neuromuscular blockade and postoperative pulmonary complications (STRONGER): a multicenter matched control cohort analysis. Anesthesiology. 2020;132:1371–1381.
- Kirmeier E, Eriksson LI, Lewald H, et al. POPULAR Contributors. Post-anaesthesia pulmonary complications after use of muscle relaxants (POPULAR): a multicentre, prospective observational study. Lancet Respir Med. 2019;7:129–140.
- Naguib M, Brull SJ, Kopman AF, et al. Consensus statement on perioperative use of neuromuscular monitoring. Anesth Analg. 2018; 127:71–80.
- Murphy GS, Szokol JW, Avram MJ, et al. Comparison of the TOFscan and the TOF-Watch SX during recovery of neuromuscular function. Anesthesiology. 2018;129:880–888.


 Issue PDF
Issue PDF