Reproduzido e modificado com permissão. Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Depressão respiratória induzida por opioides no pós-operatório: uma análise de reclamações fechadas. Anesthesiology 2015;122:659-65.
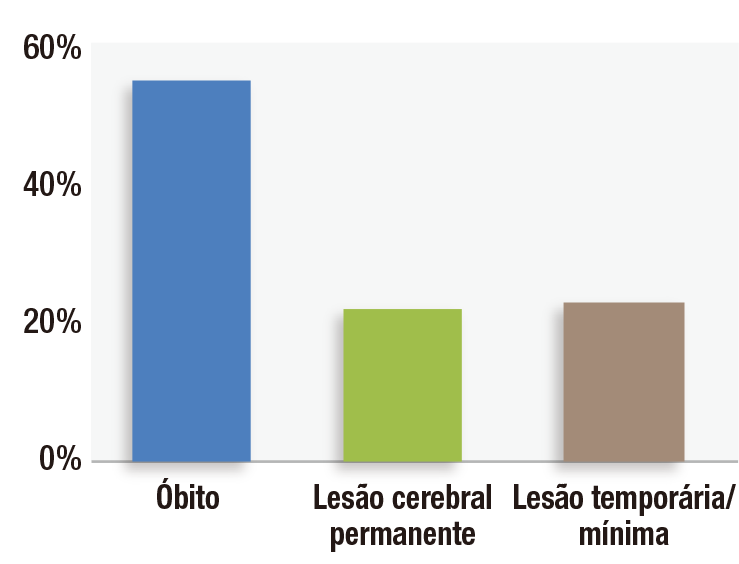
Figura 1: Gravidade da lesão em 92 processos associados a distúrbio ventilatório induzido por opioides no pós-operatório do Closed Claims Project.
O distúrbio ventilatório induzido por opioides no pós-operatório (OIVI) é uma causa evitável de lesões graves em pacientes, e muitas organizações tem se dedicado a esse problema de segurança do paciente nas últimas duas décadas. O progresso nessa área tem sido lento porque a baixa incidência desses eventos dificulta a pesquisa de desfechos em intervenções específicas. O Anesthesia Closed Claims Project estuda esses eventos raros através do exame rigoroso dos fatores associados a processos julgados de negligência anestésica obtidos de empresas de seguro profissional que cobrem aproximadamente um terço dos anestesiologistas dos Estados Unidos. O Closed Claims Project identificou 92 processos associados a OIVI.1 A metodologia não identificou os casos nos quais não houve danos causados por evento respiratório e nenhum processo foi registrado (por exemplo, resgate rápido e bem-sucedido com naloxona), nem erros diagnósticos causando morte ou lesão cerebral, o grande número de casos que nunca foram investigados em ambiente médico-legal,2 ou os casos cobertos por empresas de seguro profissional fora do Closed Claims Project. Mais de três quartos desses 92 processos de OIVI envolveram morte ou dano cerebral permanente (Figura 1).1
Devido à alta gravidade das lesões relacionadas a essa complicação, muitas organizações institucionais, profissionais e de definição de normas elaboraram diretrizes que recomendam a melhoria da monitorização pós-operatório em pacientes de alto risco recebendo opioides no pós-operatório. Essas diretrizes incluem intervenções como aumento de verificações a intervalos mais curtos, capnografia contínua e/ou oximetria de pulso contínua com alarmes centralizados e novas tecnologias, como o uso de impedância elétrica para monitorar a ventilação por minuto.3,4 Essas recomendações representam uma resposta inicial racional para um problema complicado; entretanto, identificar todos os pacientes com alto risco para OIVI não é tarefa simples. Estudos publicados sobre esse tema usando diferentes metodologias e bases de dados identificaram numerosos fatores de risco para OIVI no pós-operatório, que incluem idade avançada, sexo feminino, obesidade, baixo peso, apneia obstrutiva do sono, insuficiência renal, doença cardíaca, doença pulmonar obstrutiva crônica, doença neurológica, diabetes, hipertensão, uso crônico de opioides no pré-operatório e cirurgia de vias aéreas.5-9 Dois terços dos 92 processos associados à depressão respiratória induzida por opioides no pós-operatório do Closed Claims Project foram associados à obesidade, embora 63% tenham sido classificados como relativamente saudáveis com estado físico ASA 1 e 2.1 Polimorfismos genéticos específicos que alteram o metabolismo e o transporte de opioides estão sendo identificados e associados com maior frequência a OIVI.7,10,11 Evidentemente, muitos desses fatores de risco não serão diagnosticados, reduzindo a precisão de qualquer checklist potencial. Além disso, complicações pós-operatórias que podem aparecer, como sepse, lesão renal aguda, pneumonia, delírio e outras, podem influenciar a suscetibilidade do paciente a OIVI.
Os fatores de risco exógenos para essa complicação dependem das práticas e políticas dos profissionais e instituições de saúde e são tão importantes quanto as condições preexistentes do paciente. Os fatores de risco citados incluem o uso de anestesia geral em comparação à anestesia neuroaxial, administração pré-operatória de oxicodona ou gabapentina de longa duração, infusão contínua de opioides no pós-operatório, administração concomitante de outras medicações sedativas não opioides, múltiplos prescritores no pós-operatório e educação inadequada do profissional de saúde em relação aos sinais e sintomas de OIVI.1,12-14 Esses fatores de risco exógenos são altamente dependentes das habilidades, experiência e conhecimento de cada profissional de saúde envolvido no cuidado do paciente durante a internação e a integração e comunicação entre todos os profissionais de saúde, especialmente quando são instituídas novas diretrizes de cuidados. Recursos institucionais como a razão funcionários de enfermagem-paciente nos andares, educação continuada dos profissionais de todos os níveis para detecção dos sinais e sintomas de OIVI, prescrição e instruções de tratamento informatizadas, monitorização eletrônica aprimorada com alarmes centralizados e políticas institucionais relacionadas ao controle da dor são outras variáveis significativas que podem influenciar a incidência dessa complicação.
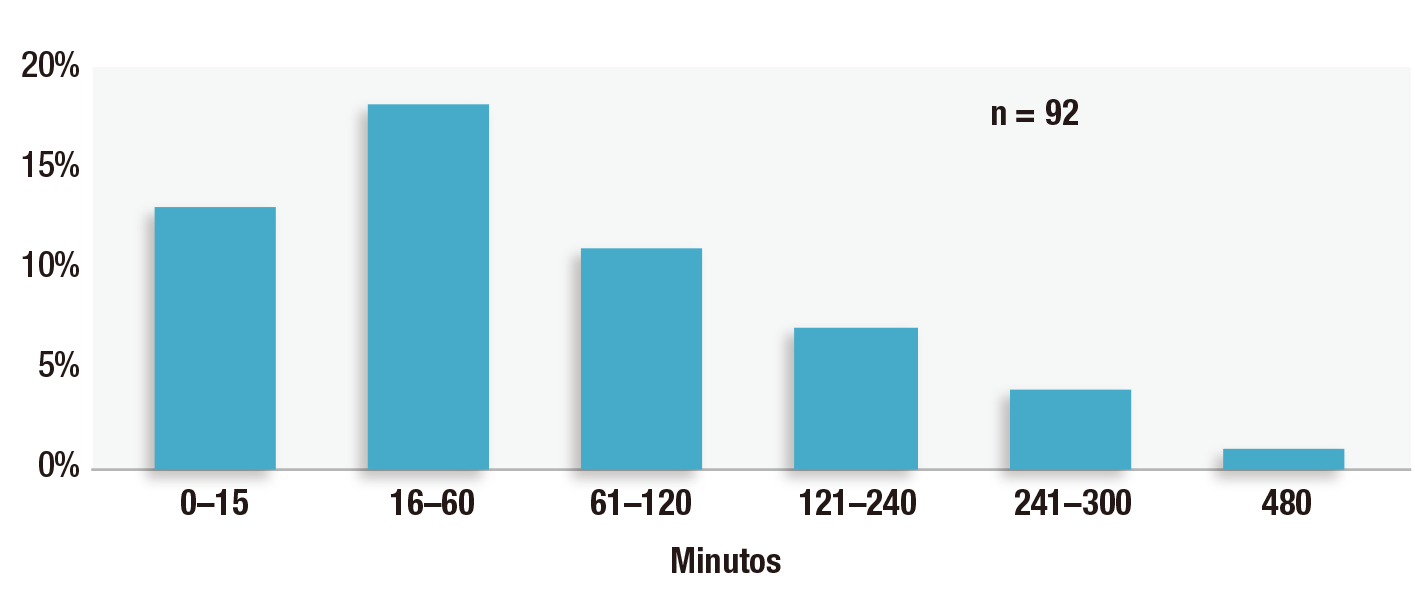
Devido a extensa lista de fatores contribuintes conhecidos e desconhecidos para OIVI no pós-operatório, os profissionais e instituições de saúde não conseguem identificar com precisão todos os pacientes que desenvolverão a complicação. À medida que a população envelhece, as epidemias de obesidade e opioides progridem, e os profissionais de saúde hospitalares cuidam de pacientes com doenças cada vez mais graves e complexas, aumenta a probabilidade de a maioria dos pacientes apresentarem um ou mais desses fatores de risco para OIVI. A recomendação da APSF e de outras organizações de instituir monitorização eletrônica contínua para todos os pacientes que recebem opioides no pós-operatório diminuiria os danos atribuíveis a fatores de risco não diagnosticados do paciente e fatores de risco variáveis do hospital e dos profissionais.15 Isso evitaria confusão na identificação de pacientes de alto risco e promoveria a padronização dos cuidados pós-operatórios para todos os pacientes. Com enfermeiros cuidando de mais pacientes, a monitorização eletrônica contínua com alarmes centralizados proporcionará vigilância mais objetiva e contínua dos pacientes. Nosso estudo demonstrou que quase um terço dos 92 processos associados a OIVI no pós-operatório apresentou evento de OIVI crítico no período de uma hora após a última verificação de enfermagem e 42% no período de duas horas após a última verificação de enfermagem (Figura 2).1 As condições flutuantes dos pacientes e o treinamento inadequado dos enfermeiros em relação aos sinais e sintomas de OIVI contribuíram para esses achados. Esses pequenos intervalos de tempo demonstram que as avaliações presenciais da enfermagem no andar não são suficientes por si só para detectar OIVI quando os enfermeiros cuidam de mais de um paciente por vez.
Reproduzido e modificado com permissão. Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659-65.
Figura 2: Tempo entre o último controle de enfermagem e a descoberta do distúrbio ventilatório induzido por opioides em 92 processos. Processos com tempo desconhecido (n = 39) e não aplicáveis (em casa, n = 3) não são mostrados.
O período de tempo crítico para o uso de monitorização eletrônica contínua no pós-operatório ocorre principalmente nas primeiras 24 horas do pós-operatório, pois os dados do Closed Claims Project demonstram que 88% desses eventos ocorreram dentro desse período (Figura 3).1 A transferência do paciente, da mais ruidosa e de maior estimulação sala de recuperação com razão enfermeiro-paciente 1:1 ou 1:2. para a enfermaria, na qual os pacientes terão menor estimulação e monitorização menos intensiva, é um período de alto risco. Nosso estudo revelou que 13% desses eventos de OIVI ocorreram no período de duas horas após a transferência para a enfermaria. Esses achados são consistentes com outros estudos que verificaram que as primeiras 24 horas representam o período de maior risco de OIVI para pacientes no pós-operatório.16-18

Reproduzido e modificado com permissão. Lee LA, Caplan RA, Stephens LS, Posner KL, Terman GW, Voepel-Lewis T, Domino KB. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659-65.
Figura 3: Momento pós-operatório de depressão respiratória induzida por opioides em 92 processos do Closed Claims Project.
Por fim, a monitorização eletrônica contínua com alarmes centralizados teoricamente seria capaz de alertar os profissionais para evolução de outras complicações pós-operatórias que podem alterar as frequências cardíaca e respiratória e a saturação de oxigênio, tais como sepse, choque hipovolêmico, pneumonia e outras doenças. Taenzer e colegas demonstraram esse conceito com sucesso, quando instituíram a vigilância eletrônica com oximetria de pulso contínua com alarmes centralizados.19,20 Eles observaram redução significativa de 50% nas transferências do andar para UTI, redução de 60% nos eventos de resgate em relação ao valor de base, e redução de mortalidade por causas relacionadas a opioides. O retorno econômico do investimento também foi altamente significativo, com economia estimada de US$ 1,48 milhões provenientes da redução das transferências de UTI na unidade inicial de estudo.21 Esse número não levou em consideração qualquer redução potencial nas despesas ao longo da vida para pacientes por morbidade reduzida ou defesa médico-legal institucional. Os dados das primeiras 24 horas em diante poderiam ser utilizados para determinar quando um paciente pode ser retirado da monitorização eletrônica contínua.
Em resumo, a estratificação de risco para OIVI é importante para o manejo perioperatório de anestésicos e medicamentos, mas não pode ser feita com alta confiabilidade. O conceito de usar apenas as condições e doenças preexistentes do paciente para identificar quais pacientes necessitam de monitorização eletrônica contínua no pós-operatório nega o expressivo impacto que o ambiente de saúde (profissionais e instituição) exerce sobre os pacientes no desenvolvimento de OIVI de maneira variável. A monitorização eletrônica contínua da oxigenação e/ou ventilação para todos os pacientes que no pós-operatório receberam opioides pelo menos nas primeiras 24 horas simplificaria e padronizaria os cuidados pós-operatórios e potencialmente reduziria a incidência de OIVI e outras complicações pós-operatórias. Esforços iniciais em instituições com recursos limitados para aumentar a monitorização de pacientes para OIVI podem se concentrar nos fatores de risco do paciente, mas as organizações devem buscar o objetivo final de monitorização de todos os pacientes que recebem opioides no pós-operatório.
O Dr. Lee é membro do conselho editorial do Boletim da APSF e é anestesiologista da equipe do Premier Anesthesia do Kadlec Regional Medical Center em Richland, WA.
O Dr. Posner atualmente é professor-pesquisador, e Laura Cheney professora de Segurança do Paciente em Anestesia do Departmento de Anestesiologia e Dor da University of Washington em Seattle, WA.
O Dr. Domino é professor de Anestesiologia da University of Washington em Seattle, WA.
Referências
- Lee LA, Caplan RA, Stephens LS, et al. Postoperative opioid-induced respiratory depression: a closed claims analysis. Anesthesiology 2015;122:659–65.
- Localio AR, Lawthers AG, Brennan TA, et al. Relation between malpractice claims and adverse events due to negligence. Results of the Harvard Medical Practice Study III. N Engl J Med 1991;325:245–51.
- Joint Commission Enhances Pain Assessment and Management Requirements for Accredited Hospitals. The Joint Commission Perspectives 2017;37:1-4. Available at https://www.jointcommission.org/assets/1/18/Joint_Commission_Enhances_Pain_Assessment_and_Management_Requirements_for_Accredited_Hospitals1.PDF Accessed Dec 3, 2017.
- Center for Clinical Standards and Quality/Survey & Certification Group. Memorandum for requirements for hospital medication administration, particularly intravenous (IV) medications and post-operative care of patients receiving IV opioids. Center for Medicare and Medicaid Services. March 14, 2014. https://www.cms.gov/Medicare/Provider-
Enrollment-and-Certification/SurveyCertificationGenInfo/Downloads/Survey-and-Cert-Letter-14-15.pdf. Accessed Dec 3, 2017. - Gupta K, Prasad A, Nagappa M, et al. Risk factors for opioid-induced respiratory depression and failure to rescue: a review. Curr Opin Anaesthesiol 2018;31:110-119.
- Khelemsky Y, Kothari R, Campbell N, et al. Incidence and demographics of post-operative naloxone administration: a 13-year experience at a major tertiary teaching institution. Pain Physician 2015;18:E827–9.
- Niesters M, Overdyk F, Smith T, et al. Opioid-induced respiratory depression in paediatrics: a review of case reports. Br J Anaesth 2013;110:175–82.
- Chidambaran V, Olbrecht V, Hossain M, et al. Risk predictors of opioid-induced critical respiratory events in children: naloxone use as a quality measure of opioid safety. Pain Med 2014;15:2139–49.
- Pawasauskas J, Stevens B, Youssef R, et al. Predictors of naloxone use for respiratory depression and oversedation in hospitalized adults. Am J Health Syst Pharm 2014;71:746–50.
- Chidambaran V, Venkatasubramanian R, Zhang X, et al. ABCC3 genetic variants are associated with postoperative morphine-induced respiratory depression and morphine pharmacokinetics in children. Pharmacogenomics J 2017;17:162–169.
- Sadhasivam S, Chidambaran V, Zhang X, et al. Opioid-induced respiratory depression: ABCB1 transporter pharmacogenetics. Pharmacogenomics J2015;15:119–26.
- Weingarten TN, Jacob AK, Njathi CW, et al. Multimodal analgesic protocol and postanesthesia respiratory depression during phase 1 recovery after total joint arthroplasty. Reg Anesth Pain Med 2015;40:330–6.
- Cavalcante AN, Sprung J, Schroeder DR, et al. Multimodal analgesic therapy with gabapentin and its association with postoperative respiratory depression. Anesth Analg 2017;125:141–146.
- George JA, Lin EE, Hanna MN, et al. The effect of intravenous opioid patient-controlled analgesia with and without background infusion on respiratory depression: a meta-analysis. J Opioid Manag 2010;6:47–54.
- Stoelting RK and Overdyk FJ for the Anesthesia Patient Safety Foundation. Conclusions and Recommendations from the June 8, 2011, Conference on Electronic Monitoring Strategies (Essential Electronic Monitoring Strategies to Detect Clinically Significant Drug-Induced Respiratory Depression in the Postoperative period). Available at https://dev2.apsf.org/initiatives.php?id=10 (last accessed Dec 3, 2017).
- Taylor S, Kirton OC, Staff I, et al. Postoperative day one: a high risk period for respiratory events. Am J Surg 2005; 190:752–6.
- Ramachandran SK, Haider N, Saran KA, et al. Life-threatening critical respiratory events: a retrospective study of postoperative patients found unresponsive during analgesic therapy. J Clin Anesth 2011;23:207–13.
- Weingarten TN, Herasevich V, McGlinch MC, et al. Predictors of delayed postoperative respiratory depression assessed from naloxone administration. Anesth Analg 2015;121:422–9.
- Taenzer AH, Pyke JB, McGrath SP, et al. Impact of pulse oximetry surveillance on rescue events and intensive care unit transfers: a before-and-after concurrence study. Anesthesiology 2010;112:282–7.
- McGrath SP, Taenzer AH, Karon N, et al. Surveillance Monitoring management for general care units: strategy, design, and implementation. Jt Comm J Qual Patient Saf 2016;42:293–302.
- Taenzer AH, Blike GT. Postoperative monitoring—the Dartmouth experience. APSF Newsletter 2012;27:1. Available at https://dev2.apsf.org/newsletters/html/2012/spring/01_postop.htm. Accessed Dec 4, 2017.


 Issue PDF
Issue PDF