在美国,甲基苯丙胺药物使用障碍 (Substance Use Disorders, SUD)已逐年上升。这类特殊的 SUD 患者给麻醉专业人员带来了挑战。通过合适的用药和措施来管理这些患者将有助于降低患者发生不良影响的风险。本综述文章将详细说明最适合于需要麻醉照护的甲基苯丙胺 SUD 患者的用药和措施。
药物滥用障碍 (SUD) 是美国日渐关注的一个话题,并继续影响家庭和社区。在美国 2014 年报告的 3.299亿人口中,有 2150 万人被诊断患有 SUD。¹ 在该国误用药物的 2150 万人中,误用甲基苯丙胺的大约有 160 万人。根据美国国家药物滥用研究所的数据,有 0.6 % 的人口报告使用过甲基苯丙胺。²由于与药物使用所致疾病有关的犯罪性和耻辱感,该数字可能会被大幅低估。一项针对 5,000 名参与者进行的调查发现,约81% 的患者给医务人员提供了有关药物滥用的虚假信息。³本研究中得出的最常见原因是患者并不想被“歧视”。³因此,麻醉专业人员应当知道的是,来到手术室接受择期手术的患者可能会隐瞒其毒品使用的真实情况。
COVID-19 全球大流行疫情也有可能会增加遇到 SUD 患者的可能性。许多以前已经戒断的患者现在会因为压力增加、社交隔离以及经济困境而复吸。⁴ 有必要牢记,SUD 作为一种流行病,即使是在全球大流行期间, 也仍然存在。毒品(比如甲基苯丙胺)的使用并未走远或减少,其发生频率反而还有所增加。⁴ 每名麻醉专业人员都有必要知道在围手术期背景下使用甲基苯丙胺可能会导致致死性影响,其后果可能包括高血压危象、高血压导致的心血管功能衰竭以及死亡。⁵ 遵照迄今为止多数文献中公布的用药规范可以减少潜在的发病和死亡,并确保合适照护有这种特殊 SUD 的患者。
甲基苯丙胺的药理学
甲基苯丙胺的国际纯粹与应用化学联合会 (IUPAC) 名称是 (2S)-N-甲基-1-苯丙醇-2-胺。⁶ 尽管尚未完全搞清楚其作用机制,但甲基苯丙胺可以导致内源性单胺类物质多巴胺、去甲肾上腺素和血清素的释放(图 1)。
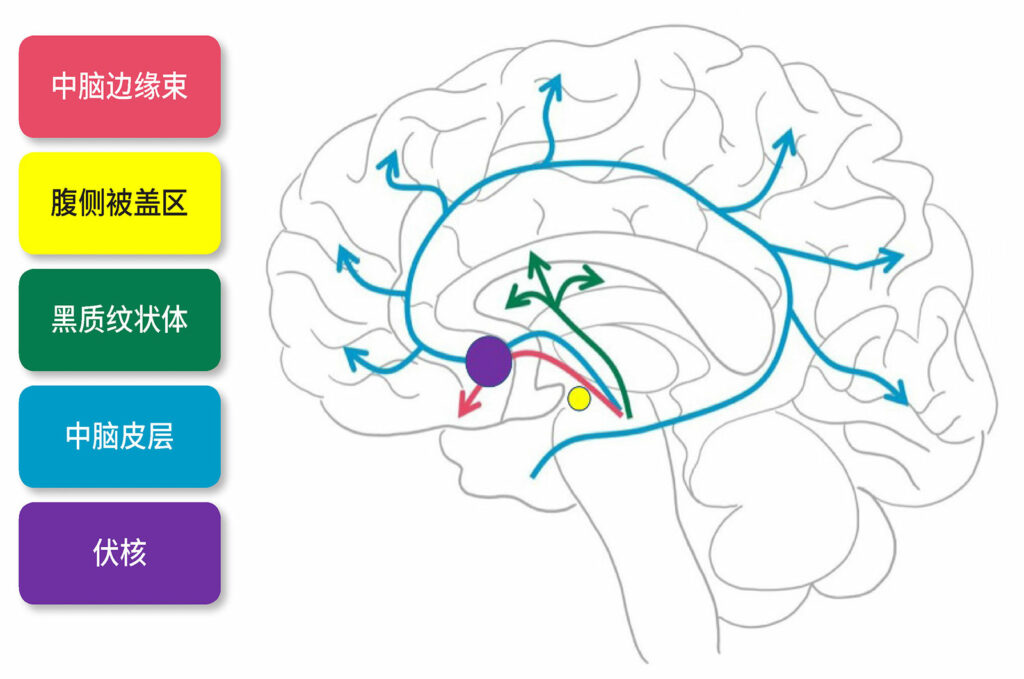
图 1.多巴胺的释放。多巴胺可激活中脑缘、中脑皮层束和黑质纹状体通路。本通路从腹侧被盖区延伸至伏核,负责使用甲基苯丙胺后的欣快感。7
来源:改编自 SITNBostonHaynes et al, 2018.7
https://sitn.hms.harvard.edu/flash/2018/dopamine-smartphones-battle-time/
,访问时间 2021 年 4 月 16日
一旦释放,单胺类物质可与合适的突触后受体结合,以影响某种反应。多巴胺释放进入伏隔核中遵循与社交互动、性、饮食和锻炼等自然奖励相同的路径,但甲基苯丙胺的刺激作用导致从内源性储库中释放出的多巴胺比自然奖励多 2 -10 倍,从而导致多巴胺释放量超过 1000% 基础水平。7-10 甲基苯丙胺还可与内源性阿片系统发生相互作用,进一步增高调节奖励中心的伏核中的内啡肽水平。11
最后,由于身体无法存储囊泡中大量释放的单胺类物质而引起的多巴胺缺乏可导致抑郁和停药感觉,这可能会进一步诱发寻药行为。12 这些生理变化合并在一起,在患者中创造了一种近乎躁郁的状态,这可能会造成药物误用的恶性循环。
单胺类物质的外周作用最终会导致一系列复杂的全身事件。11 那些因甲基苯丙胺而中毒的人会出现各种体征和症状(表 1)。
表 1.甲基苯丙胺中毒的体征和症状。11,13,14
| 甲基苯丙胺中毒的症状(根据分类) |
| 中枢神经系统 |
| 烦乱 |
| 坐立不安 |
| 瞳孔放大 |
| 癫痫 |
| 高热症 |
| 焦虑 |
| 警惕性提高 |
| 幻觉 |
| 精神病 |
| 心胸 |
| 高血压 |
| 心动过速 |
| 节律障碍 |
| 恶性心律失常 |
| 心肌梗死 |
| 冠状动脉血管痉挛 |
| 主动脉夹层 |
| 支气管扩张 |
| 急性呼吸窘迫综合征 |
| 肺动脉高压 |
| 右心衰 |
| 心搏骤停 |
| 死亡 |
| 出汗 |
| 肌肉骨骼 |
| 横纹肌溶解症 |
| 重度肌肉痉挛 |
| 其他 |
| 缺血性结肠炎 |
| 代谢性酸中毒 |
| 胎盘早剥 -> 胎儿死亡 |
高热是这些患者出现的一种常见症状,这似乎与肌肉活动有关,因此,退烧药对降低体温无作用。13 使用甲基苯丙胺需要警惕的医学问题是发生肢体碰撞后出现的突发性心搏停跳。等容性肌肉收缩可导致严重的酸中毒、横纹肌溶解症、高钾血症和突发性心搏停跳。13,15
甲基苯丙胺的药代动力学
甲基苯丙胺的药代动力学和代谢高度依赖于给药途径和剂量,或重复给药。甲基苯丙胺消除作用是通过肝脏路径和几种肾脏路径中的细胞色素 CYP2D6 进行的。排泄发生在用药后前 20 小时内,但高度依赖于尿液 pH。对于碱性尿液,排泄率可能会低至 2%,但对于酸性尿液,排泄率可能会高达 76%。16,17 甲基苯丙胺的作用持续时间通常约为 24 小时。但是,人与人之间的消除和临床作用变化很大,某些停药症状持续时间可长达 20 天。13,16,18
临床背景下甲基苯丙胺的监测是通过血清或尿分析进行的。如果患者正在使用甲基苯丙胺,则其甲基苯丙胺或代谢产物苯丙胺的检测结果可能呈阳性。16,17 在此时,还没有定量的毒理学筛查结果可以等同于临床中毒或麻醉状态下生理反应的严重程度。因此,对于甲基苯丙胺监测结果呈阳性的任何患者,难以确定麻醉状态下的相关风险。
指导方针和预防措施
甲基苯丙胺影响下患者的麻醉照护是几个核心理念的中心议题。如果患者是急性中毒并需要紧急手术,则医务人员应避免对这些患者进行身体约束,因为任何导致肌肉剧烈收缩的干预措施都可能会导致心血管功能衰竭。13,15 相反,通过苯二氮平类药物镇静来进行化学约束是主要的治疗手段。文献建议,在患者停止反抗前,每隔 8 -10 分钟静脉给予 2 mg 咪达唑仑。有些患者可能需要给予高达 20 mg 剂量。13 如果苯二氮平类药物不能有效治疗精神病,则可给予二线药物,如氟哌啶醇等。苯二氮平类药物和氟哌啶醇可通过拮抗中枢神经系统中的多巴胺活性来减轻甲基苯丙胺的交互影响。19
在给予镇静剂以后,高血压患者最可能会恢复至基线状态;但是,麻醉专业人员可能会发现有些患者存在难治性高血压。在这些病例中,可使用多种药物来治疗高血压(表 2)。
表 2。治疗甲基苯丙胺相关性高血压的药物和考量。13,14,19,20-22
| 药物 |
考量 |
| 1.咪达唑仑 | 重复给予镇静所需的剂量,高剂量咪达唑仑可导致呼吸损害 |
| 2.氟哌啶醇 | QT 间期延长风险、精神抑制恶性综合征风险均可能触发锥体束外症状 |
| 3.右旋美托咪啶 | 在产科患者中开展了少数几项研究 |
| 4.硝化甘油 | 血压降低可能会导致轻度反射性心动过速 |
| 5.硝普盐 | 血压降低(并伴有反射性心动过速)可能会导致氰化物毒性 |
| 6.酚妥拉明 | 麻醉专业人员可能没有可以使用的酚妥拉明 |
| 7.尼卡地平(二氢吡啶 CCB) | 血压降低(并伴有反射性心动过速) |
| 8.戊脉安(非二氢吡啶 CCB) | 血管舒张作用较小,并伴有反射性心动过速,或可引起严重心动过缓。 |
| 9.拉贝洛尔 | 可导致冠状动脉痉挛。可导致与非对抗 α 刺激作用相关的高血压。 |
CCB = 钙离子通道阻断剂
有关通过使用 β-阻断剂来进行“无拮抗 α 刺激”这一理念变得越来越有争议。一些作者发表了系统性综述,但很少有不良结果,同时,在使用非选择性 β-阻断剂时(如拉贝洛尔等),没有观察到不良结果。22 而且,β-阻断剂还被用于治疗其他的肾上腺素能亢进性疾病,如甲状腺功能亢进等。22但是,美国心脏病学会基金会和美国心脏联合会在其最新的 2014 执行总结中提出,表现出急性中毒症状的患者不得给予 β-阻断剂,因为有可能会加重冠状动脉痉挛。23 因此,使用苯二氮平类药物来抑制儿茶酚胺增加仍然是甲基苯丙胺高血压的主要治疗方法。13
对于需要立即进行手术干预的甲基苯丙胺SUD 患者,应严密监测与儿茶酚胺减少相关的高血压。插入动脉导管可能需要谨慎。如遇低血压,可考虑使用直接作用的血管加压药进行治疗,如去甲肾上腺素、肾上腺素、多巴胺或苯肾上腺素等。13,24 尽管并未禁止进行脊髓或硬膜外麻醉,但许多麻醉专业人员在麻醉过程中选择避免进行椎管内麻醉,因为交感神经阻断术会导致顽固性低血压,尽管可以使用血管加压药进行治疗。
甲基苯丙胺 SUD 患者发生横纹肌溶解症的风险增高。该多因素问题可能是由于中毒时液体摄入减少、灌注减少导致的血管收缩以及对骨骼肌的直接毒性作用导致的。25 琥珀酰胆碱可加重横纹肌溶解症,应将其视为气道管理的相对禁忌症。因此,罗库溴铵或维库溴铵是麻痹药物选项,如临床医生有舒更葡糖则可能更好。13 如患者出现了横纹肌溶解症,则需进行液体推注给药。13 此外,临床医生还应调整呼吸机设置,以避免代谢性酸中毒。13 任何患者如不进行积极治疗,均可能会导致症状出现不可逆进展,并可能会导致患者死亡。13
除开急性中毒以外,有些患者还可能会长期服用安非他明,作为诸如注意力缺陷多动症等疾病的诊断性治疗手段。研究人员发现,对于该患者子集,麻醉状态下血压不稳定的风险并未增高。因此,作为其治疗方案一部分而服用安非他明的患者可继续在围手术期间服用药物,无需暂停。26,27
产妇的用药考量
使用甲基苯丙胺的孕妇可能会出现高血压、羊膜提前破裂、出血或胎盘早剥。28 如患者非常躁动,则苯二氮平类药物是最佳的治疗选项,尤其是与诱导前的身体约束措施相比。从上世纪六十年代以来的过往病例报告将苯二氮平类药物列为明确与与腭裂和心脏缺陷相关的先天性畸形促进因素。尽管先前有关苯二氮平类药物与先天性畸形之间存在关联的研究存在瑕疵,但对孕妇暴露的极度规避导致了进一步研究的缺失。29,30 最近,已出现了更有说服力的数据,有几项研究显示,多数苯二氮平类药物(临近手术前服用的或在怀孕期间为控制焦虑症状而服用的)与先天性畸形之间没有相关性。29,31-33 对于使用甲基苯丙胺的躁动产妇,临床医生停用苯二氮平类药物显然是不明智的,因为产妇在挣扎时仍然存在心血管功能衰竭的风险,这可能会导致产妇和胎儿死亡。但是,麻醉专业人员可能会在妊娠早期选择给患者使用氟哌啶醇。34 通常不使用甲基苯丙胺,因为可能会增加儿茶酚胺水平,并导致产生高血压。22
麻醉专业人员对新生儿药物成瘾性的担忧也可能会导致其迟迟不愿使用苯二氮平类药物。研究人员已发现,生物利用度增高可能会导致新生儿体内的苯二氮平类药物暴露水平比母亲高三到四倍。35 但是,如使用低剂量 (0.02–0.025mg/kg) 的咪达唑仑,则在接受剖腹前给药后,新生儿的 Apgar 评分并无差异。28,30 产妇也存在因为身体约束引起肌肉剧烈收缩而导致心血管功能衰竭的风险。由于这可能会导致产妇和新生儿死亡,因此,仍应当谨慎考虑通过化学约束方法来镇静躁动的孕妇,并倾向于考虑分娩后新生儿的呼吸状态。
血清素毒性
血清素毒性(也称为血清素综合征)是指中枢神经系统中的血清素能活性增加,有可能导致死亡的一种情况。36血清素毒性有一种可预测的后果,即中枢神经系统和外周受体中的血清素能活性过高,从而导致出现多种症状(因释放过多的血清素所致),如狂躁、高血压、心动过速和出汗等。已经有好几例因为一次服用甲基苯丙胺而导致发生血清素毒性的病例。37 血清素毒性还可能因为使用曲马多、哌替啶、阿片类药物(例如,芬太尼)和亚甲蓝而加重。36,38,39 芬太尼对于麻醉专业人员有特别意义,因为这种药物是手术室内更常用的阿片类药物。
如果麻醉专业人员遇到了发生血清素毒性的甲基苯丙胺SUD 患者,建议将苯二氮平类药物作为患者和新生儿的一线治疗药物。但是,与甲基苯丙胺中毒不同,血清素毒性还可使用非选择性血清素拮抗剂(如赛庚啶和利培酮等)来进行治疗。血清素毒性也可使用突触后多巴胺阻断剂(如氯丙嗪等)来进行治疗。40
小结
甲基苯丙胺SUD 呈上升趋势,由于 COVID-19 全球大流行带来的压力、社交隔离和经济紧张加剧,情况可能更加严糟。这类特殊的 SUD 患者给麻醉专业人员带来了挑战。需要注意,应使用化学约束措施而不是身体约束措施来限制肌肉收缩,因其可能会导致心血管功能衰竭。由于可能会发生严重低血压,因此需要使用直接起作用的血管加压药,但是,如果患者有高血压,则应谨慎使用 β-阻断剂。最后,甲基苯丙胺 SUD 患者可能会出现横纹肌溶解或血清素毒性;医务人员应避免给予相关的触发药物。
Jennifer Krogh, MSN, CRNA 是耶鲁护理学院(康涅狄格州橙县)的 DNP 学生。
Jennifer Lanzillotta-Rangeley, PhD, CRNA 是辛辛那提大学护理学院(美国俄亥俄州辛辛那提市)的助理教授,同时也是高原地区医院(俄亥俄州希尔斯伯勒市)的麻醉科主任。
Elizabeth Paratz, MD 是圣文森特医院(澳大利亚维多利亚州墨尔本市)的心脏病医师。
Lynn Reede, DNP, CRNA 是东北大学(美国马萨诸塞州州波士顿市)护理学院护士麻醉项目的临床副教授。
Linda Stone, DNP, CRNA 是北科罗拉多州大学格林斯博罗 DNP 护士护士麻醉集中培训项目(北科罗拉多州格林斯博罗市)的助理项目主管和临床助理教授。
Joseph Szokol, MD 是美国麻醉医师协会的首席健康政策官、南加州大学凯克医学中心(加州洛杉矶市)导师和医生发展部门的临床麻醉学教授和执行总监。
Laura Andrews, PhD 是耶鲁护理学院(康涅狄格州橙县)成人/老年医学紧急救护系的副教授和专业负责人。
Joan Kearney, PhD, APRN, FAAN 耶鲁大学(康涅狄格州西汉文市)的副教授。
作者没有利益冲突。
参考文献
- Lipari RN, Van Horn SL. Trends in substance use disorders among adults aged 18 or older. The CBHSQ Report. 2017.
- National Institute on Drug Abuse. What is the scope of methamphetamine misuse in the United States? https://www.drugabuse.gov/publications/research-reports/methamphetamine/what-scope-methamphetamine-misuse-in-united-states. Accessed November 6, 2019.
- Levy AG, Scherer AM, Zikmund-Fisher BJ, Larkin K, Barnes GD, Fagerlin A. Prevalence of and factors associated with patient nondisclosure of medically relevant information to clinicians. JAMA Netw Open. 2018;1:1–8
- Wan W, Long H. ‘Cries for help’: drug overdoses are soaring during the coronavirus pandemic. Washington Post. July 1, 2020.
- Gao W, Elkassabany N. Drugs of Abuse. Gupta A, Singh-Radcliff, N. Pharmacology in anesthesia practice. New York, NY: Oxford University Press. 2013;391–411.
- National Center for Biotechnology Information. PubChem compound summary: Methamphetamine. https://pubchem.ncbi.nlm.nih.gov/compound/methamphetamine. Accessed April 29, 2019.
- Haynes T. Dopamine, smartphones, and you: a battle for your time. Science in the News. http://sitn.hms.harvard.edu/flash/2018/dopamine-smartphones-battle-time/. Accessed August 12, 2020.
- Allerton M, Blake W. The “Party Drug” crystal methamphetamine: Risk factor for the acquisition of HIV. Perm J. 2008;12:56–58.
- Beaulieu P. Anesthetic implications of recreational drug use. Can J Anaesth. 2017;64:1236–1264.
- National Institute on Drug Abuse. Methamphetamine. https://www.drugabuse.gov/publications/drugfacts/methamphetamine. Accessed November 6, 2019.
- Courtney KE, Ray LA. Methamphetamine: an update on epidemiology, pharmacology, clinical phenomenology, and treatment literature. Drug Alcohol Depend. 2014;143:11–21.
- Kish SJ. Pharmacologic mechanisms of crystal meth. CMAJ. 2008;178:1679–1682.
- Boyer EW, Seifert SA, Hernon C. Methamphetamine: acute intoxication. UpToDate. Ed. Traub SJ, Burns MM: UpToDate; 2019. https://www.uptodate.com/contents/methamphetamine-acute-intoxication. Accessed October 24, 2019.
- Paratz ED, Cunningham NJ, MacIsaac AI. The cardiac complications of methamphetamines. Heart Lung Cir. 2016;25:325–332.
- National Criminal Justice Reference Service. White paper report on excited delirium syndrome. Updated September 2009. https://www.ncjrs.gov/App/Publications/abstract.aspx?ID-260278. Accessed September 28, 2019.
- Volkow ND, Fowler JS, Wang G, et al. Distribution and pharmacokinetics of methamphetamine in the human body: clinical implications. PLoS One. 2010;5:1–6
- Oyler JM, Cone EJ, Joseph RE, Moolchan ET, Huestis MA. Duration of detectable methamphetamine and amphetamine excretion in urine after controlled oral administration of methamphetamine in humans. Clin Chem. 2002;48:1703–1714
- Huestis MA, Cone EJ. Methamphetamine disposition in oral fluid, plasma, and urine. Ann NY Acad Sci. 2007;1098:104–121.
- Richards JR, Derlet RW, Albertson TE. Methamphetamine toxicity treatment and management. Medscape. https://emedicine.medscape.com/article/820918-treatment#d10. Accessed December 7, 2018.
- Johnson BA, Wells LT, Roache JD, et al. Isradipine decreases the hemodynamic response of cocaine and methamphetamine. Am J Hypertens. 2005;18:813–822.
- Lam v, Shaffer RW. Management of sympathomimetic overdose including designer drugs. Hyzy RC, McSparron J. Evidence-based critical care: a case study approach. 2nd Edition. Switzerland. Springer Nature Switzerland. 2020.
- Richards JR, Albertson TE, Derlet RW, et al. Treatment of toxicity from amphetamines, related derivatives, and analogues: a systematic clinical review. Drug Alcohol Depend. 2015;150:1–13
- Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with Non-ST-elevation acute coronary syndromes. J Am Coll Cardiol. 2014;64:e139–e288.
- Selvaggi G, Spagnolol AG, Elander A. A review of illicit psychoactive drug use in elective surgery patients: Detection, effects, and policy. Int J Surg. 2017;48:160–165.
- Eilert RJ, Kliewer ML. Methamphetamine-induced Rhabdomyolysis. Int Anesthesiol Clin. 2011;49:52–56.
- Cartabuke RS, Tobias JD, Rice J, Turmin D. Hemodynamic profile and behavioral characteristics during induction of anesthesia in pediatric patients with attention deficit hyperactivity disorder. Pediatr Anesth. 2017;27:417–424.
- Fischer SP, Schmiesing CA, Guta CG, Brock-Utne JG. General anesthesia and chronic amphetamine use: Should the drug be stopped preoperatively? Anesth Analg. 2006; 103:203-206.
- Pham T, Tinajero Y, Mo L, et al. Obstetrical and perinatal outcomes of patients with methamphetamine positive drug screen on labor and delivery. Am J Obstet MFM. 2020;2:1–7.
- Senel AC, Mergan F. Premedication with midazolam prior to caesarean section has no neonatal adverse effects. Braz J Anesthesiol. 2014;64:16–21.
- Shergill AK. Guidelines for endoscopy in pregnant and lactating women. Gastrointest Endosc. 2012;76:18–24.
- Flölich MA, Burchfield DJ, Euliano T, Canton D. A single dose of fentanyl and midazolam prior to Cesarean section have no adverse neonatal effects. Can J Anesth. 2006;53:79–85.
- Bellantuono C, Tofani S, Sciascio GD, Santone G. Benzodiazepine exposure in pregnancy and risk of major malformations: A critical overview. Gen Hosp Psychiatry. 2013;35:3–8.
- Upadya M, Saneesh P. Anaesthesia for non-obstetric surgery during pregnancy. Indian J Anaesth. 2016;60:234–241.
- Betcher HK, Montiel C, Clark CT. Use of antipsychotic drugs during pregnancy. Clin Schizophr Relat Psychoses. 2019;6:17–31.
- Radojcic MR, Marroun HE, Miljkovic B, et al. Prenatal exposure to anxiolytic and hypnotic medication in relation to behavioral problems in childhood: a population-based cohort study. Neurotoxicol Teratol. 2017;61:58–65.
- Greenier E, Lukyanova V, Reede L. Serotonin syndrome: Fentanyl and selective serotonin reuptake inhibitor interaction. AANA J. 2014;82:340–345.
- Rahmani SH, Hassanian-Moghaddam H, Ahmadi S. Serotonin syndrome following single ingestion of high dose methamphetamine. J Clin Toxicol. 2011;1:1–3.
- Smischney NJ, Pollard EM, Nookala AU, Olatoye OO. Serotonin syndrome in the perioperative setting. ACF Case Rep J. 2018;19:833–835.
- Gillman PK. CNS toxicity involving methylene blue: The exemplar for understanding and predicting drug interactions that precipitate serotonin toxicity. J Psychopharmacol. 2010;23:429–436.
- Moss MJ. Serotonin toxicity: Associated agents and clinical characteristics. J Clin Psychopharmacol. 2019;39:628–633.


 Issue PDF
Issue PDF