猪流感惨象
 1976 年 1 月,新泽西州德克里特堡美国陆军培训中心的一群年轻健康军人出现了不明原因的呼吸道疾病。其中几名被收治住院。一名新兵因拒绝住院而死亡。死因被证实为 H1N1 – 导致 1918 全球大流行的流感病毒株。该病毒株导致的疾病被认为是最危险型流感,但自 1918 年以来,多数感染者仅限于与猪接触的相关人员。这是 58 年来第一次明确发现 H1N1 通过人与人接触而快速传播的情况。在 500 名青年男性中,13 人在数周内发病, 1 人死亡。
1976 年 1 月,新泽西州德克里特堡美国陆军培训中心的一群年轻健康军人出现了不明原因的呼吸道疾病。其中几名被收治住院。一名新兵因拒绝住院而死亡。死因被证实为 H1N1 – 导致 1918 全球大流行的流感病毒株。该病毒株导致的疾病被认为是最危险型流感,但自 1918 年以来,多数感染者仅限于与猪接触的相关人员。这是 58 年来第一次明确发现 H1N1 通过人与人接触而快速传播的情况。在 500 名青年男性中,13 人在数周内发病, 1 人死亡。
在美国疾控中心 (Center for Disease Control, CDC) 的科学家看来,流感的发生似乎是一场灾难。拥有了免疫接种技术,这一技术在1918年全球流感大流行期间及1957年和1968年小规模地方性流感疫情期间尚未获得,CDC迫切要求进行大规模疫苗接种。1976 年 3 月 24 日,因脊髓灰质炎疫苗而声名鹊起的主席 Gerald Ford 在两名副手Sabin 和 Salk 博士的簇拥下宣布:
“我认为,除非我们采取有效的应对措施,否则这种危险疾病很可能会在明年秋季和冬季在美国流行开来。此刻,请允许我明确声明:没有人知道这种威胁的严重性到底如何。不过,我们不能拿国民的生命健康冒险。因此,我今天在这里宣布将采取以下措施。我正在要求国会在四月份休会前拨款 1.35 亿美元,用于生产足够的疫苗,为美国每一位男性、女性和儿童接种”。1
疫苗的现场试验将在四月份开始。大规模免疫将从 1976 年 10 月 1 日开始。十一天后,匹兹堡的三名老年患者几乎是在疫苗接种后立即死亡。阿勒格尼根尼县卫生部门暂停了该疫苗接种计划。在明尼苏达州,卫生当局注意到有几例格林-巴利综合征。这之后,不明原因的死亡和格林-巴利综合征(流感自身和其他流感疫苗的一种并发症)发生率升高。2当冬季没有 H1N1 病例时,可感知的风险/收益转变为全部风险,因此该免疫接种计划在 12 月份被叫停。
在 1976 “猪流感惨象”之后,新的免疫接种计划应运而生。颇具讽刺意味的是,那些曾在 1976 年接种过猪流感疫苗的受试者,在2009 年 H1N1 全球大流行期间得到了免疫保护。31976年的猪流感疫苗接种计划也预示着我们在今天的疫苗接种计划中所看到的,在宣传疫苗的好处和疫苗安全性方面所面临的许多挑战。
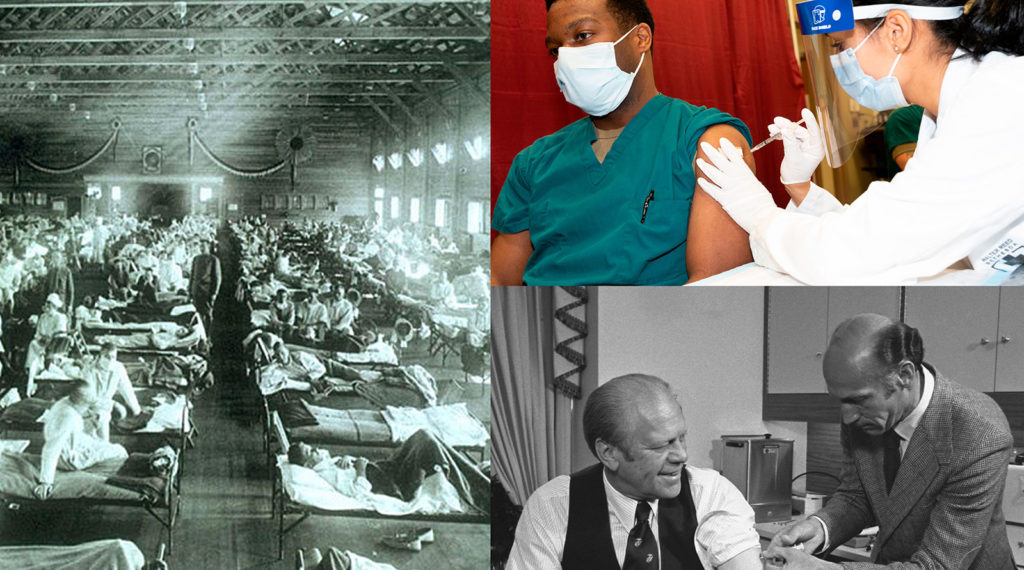
左图:1918 流感全球大流行,国家卫生与医学博物馆,武装力量病理学研究所,华盛顿特区,美国;右上图:上尉 Isaiah Horton 博士正在接种 COVID-19 疫苗,美国国防部供稿;右下图:美国总统杰拉尔德·福特正在接种猪流感疫苗,杰拉尔德·福特总统图书馆供稿;
新冠疫苗的曲速行动 (Operation Warp Speed)
与 1976 猪流感疫情不同,当时在德克斯堡首次暴发H1N1后没有出现后续 病例,但是,截至 2021 年 4 月 5 日,全球已有超过 1.3 亿个病例和 280 万人死于SARS-CoV-2(图 1)。在美国,1/11 的美国人感染了 SARS-CoV-2 ,大约有 1/600 的美国人死于 COVID-19(截至2021年 3月,死亡人数超过 540,000人)。
截止 2021 年 4 月 5 日的全球预期
COVID 疫情前所未有地集中了全球的科研力量。在美国,“曲速行动”是一项公共/私营部门合作项目,以便为生产疫苗和其他治疗药物的公司提供近乎无限的政府支持来应对 COVID-19。欧洲、印度和中国也有类似的计划,并取得了空前成功。
根据世界卫生组织的统计,当前处于临床开发阶段的疫苗有 82 款(表 1)。4 其中,有 13 款疫苗目前至少在 1 个国家获准使用。5 所有这些疫苗均被证实有效。已经出现的唯一严重安全问题是阿斯利康公司疫苗所导致的、可能性极小的血栓症。我将重申:唯一的严重安全问题是阿斯利康公司疫苗所导致的、可能性极小的血栓症。
表 1:开发中的疫苗平台。33
| 平台 | 候选疫苗 |
| 蛋白亚单位 | 28 |
| 病毒载体(非复制型) | 12 |
| DNA | 10 |
| 灭活病毒 | 11 |
| RNA | 11 |
| 病毒载体(复制型) | 4 |
| 病毒样颗粒 | 4 |
| 减毒活疫苗 | 2 |
| 复制型病毒载体 + 抗原递呈细胞 | 2 |
| 非复制型病毒载体 + 抗原递呈细胞 | 1 |
疫苗刺激免疫系统。很明显,这是重点!你知道这种感觉就像:疲乏、肌痛、嗜睡以及全身性“流感样”症状。这种反应并不是病毒自身导致的。这仅仅是你的免疫系统被激活时的一种感觉而已。由于疫苗将激活免疫系统,因此,任何疫苗都会使你感觉像生病一样,这种症状将持续数小时,也有可能持续一两天。就像你应该预料到注射会有点疼,因为他们把针头刺进你的手臂,你也可能体会到感染病毒的感觉,因为注射疫苗会激活你的免疫系统。
安全问题是:除了让你觉得像感染了病毒以外,疫苗还有哪些不良影响?
疫苗安全性和有效性
1.BNT162b2 是美国辉瑞 (Pfizer) 与德国生物新技术 (BioNTech) 公司共同开发的一款 mRNA 疫苗。这是在美国通过紧急使用授权 (Emergency Use Authorization, EUA) 程序*获批的首款疫苗。在对 43,548 名受试者进行的一项研究中,该疫苗显示出95%的显著疗效6 对重症防治几乎是 100% 有效。7 仅有 1 名患者在注射疫苗(总接种人数 > 20,000)以后出现了严重的 COVID-19。常见的不良事件仅限于注射部位疼痛和流感样症状。在 3 期临床试验中证实的安全性和有效性在该疫苗后续被大规模应用于以色列时得到了印证。8
在BNT162b2 免疫接种计划启动后不久,观察到几例过敏反应。9 最近的评估结果是,过敏反应风险为 1/100,000。10 该 mRNA 疫苗含有一种脂质纳米微粒,以促进 mRNA 进入细胞。目前认为,脂质纳米微粒是导致产生过敏反应的主要原因。11 通过接种后立即对受种者进行长达30分钟的监测,有助于降低过敏反应风险,从而使过敏反应导致的伤害风险降至接近于 0。CDC 估计,没有与 BNT162b2 疫苗有关的死亡。12
2. mRNA-1273 是美国莫得纳 (Moderna) 公司开发的一款 mRNA 疫苗。这是在美国获得 EUA 批准的第二款疫苗。在对 30,420 名受试者进行的一项 3 起临床试验中,mRNA-1273 疫苗也显示出94%的显著有效性。从这个角度来看,FDA 为疫苗批准设置了 50% 的有效性界限 。13
莫得纳 mRNA-1273 疫苗的风险与 Pfizer/BioNTech 疫苗相同。14 这是符合预期的,因为两款疫苗均使用了相同的脂质纳米微粒来促进 mRNA 进入细胞。15 发生过敏反应的风险约为 1/200,000。还没有出现死亡或严重伤害的病例。另外,mRNA-1273 疫苗受种者在免疫系统增强时也会有轻微的不适。
3.AD26.COV2.S不是一款 mRNA 类型的疫苗,而是由美国强生 (Johnson & Johnson) 公司开发的一款非复制型病毒载体疫苗。这是在美国获得 EUA 批准的第三款疫苗。在对 44,325 名成人进行的 3 期临床试验中发现,有效性为 72%(美国)、66%(拉美国家)和 57%(南非)。16 尚未出现死于 COVID-19 的免疫接种患者。在同行评议文献中,还未见到相关的安全性数据。不过,在 FDA 的简报中,已经详细描述了安全性特征17:“至数据截止日期 2021 年 1 月 22 日的安全性分析包含了年龄 ≥18 岁的 43,783 名随机入组 (1:1) 参与者,中位随访时间为 2 个月。该分析结果支持疫苗具有良好的安全性特征,没有发现任何阻止签发 EUA 的特殊安全问题”。在临床研究中没有发生过敏反应的情况,但有一人在接种后两天出现了超敏反应,未将其归类为过敏反应。*
4.AZD1222(也称为 ChAdOx1 nCoV-19)是牛津大学与英国阿斯利康公司 (AstraZeneca) 合作开发的一款腺病毒载体疫苗。该疫苗已被整个欧洲、亚洲和南美地区批准使用。AstraZeneca 近期在美国完成了 3 期临床试验,并宣布了在美国获得 EUA 批准的计划。
AZD1222 似乎从一开始就被诅咒了。在关键的 3 期临床试验中,出现了一起给药错误,导致部分患者接种剂量低于预期。令人惊讶的是,这些患者出现了更好的免疫反应,但尚不清楚为何会出现这种情况!在中期分析中,在按方案规定接受较高剂量的患者中,疫苗的有效性为 62%,在接受极低剂量的患者中,疫苗的有效性为 90%。18 在最终分析中,但单次给予标准剂量以后,疫苗的有效性为 76%。19 在 21 天以后,疫苗接种组中没有任何患者需要住院,也没有 COVID 死亡病例。
安全性分析发现了两起令人担忧的不良事件:一例横贯性脊髓炎,以及一例接种后高烧 40°C,原因不明。两个病例均已缓解。后续还报告了一例横贯性脊髓炎,但后来研究者确定与疫苗接种无关。
在 AZD1222 获批以后,南非在《新英格兰医学杂志》上发表的一篇论文显示,该疫苗对在南非广泛流行的 B.1.351 变异毒株无效。20
2021 年 3 月,挪威有三名患者在接种 AZD1222 疫苗后发生血栓事件,其中一名患者死亡。挪威暂停了该疫苗的使用,并等待调查。欧洲还报告了另外几起血栓事件,包括发生在英国的 22 起。21 澳大利亚也报告了一例。22 这些病例的不寻常之处在于,它们与与低血小板计数有关,提示其与肝素诱导的血小板减少症有机制性关联。23 为此,丹麦、挪威、冰岛、爱尔兰、荷兰、德国、意大利、法国、西班牙、葡萄牙、瑞典、卢森堡、塞浦路斯和拉脱维亚均暂停了该疫苗的使用。随后,欧洲药物管理局、世界卫生组织24 和 AstraZeneca 25 确定,血栓症病例与疫苗无关,并建议继续使用。
2021 年 3 月 22 日,AstraZeneca 宣布了美国 3 期临床试验中 32,449 名受试者的结果。26 该疫苗的有效性为 79%,对防止出现重症 100% 有效。数据和安全监查委员会审查了血栓事件,包括脑静脉窦血栓症,未发现风险增高的证据。在该试验中,没有出现脑静脉窦血栓症病例。次日,数据和安全监查委员会 (Data and Safety Monitoring Board, DSMB) 通过美国国家过敏症与传染病研究所发布了一份声明,对 AstraZeneca 的新闻稿提出了质疑,其中提出,DSMB 表示对 AstraZeneca 可能包含了来自试验的过期信息感到担忧,这可能提供了关于疗效数据的不完整观点。27
如以上所述,AZD1222 似乎从临床试验中的给药错误开始就已被诅咒。因其较低剂量即可产生较大疗效,鉴于其对非常罕见的横贯脊髓炎病例和血栓的担忧,以及目前对数据筛选的担忧,因此争论还在继续。有关 ADZ1222 的是非曲直,Nature News 上发表了一篇极好的综述文章。28 英国医药保健品监管督管理局已经发布了有关接种疫苗后发生血栓症与血细胞减少症的诊断和治疗指南。29
我可以注射 AZD1222 疫苗吗?当然可以!该疫苗已经注射了超过 1700 万人。目前已经发生了 50 起栓塞事件,发生率约为百万分之三。当前的 COVID-19 病死率已经升至大约 2.4%,在所有 COVID-19 患者中,超过 20% 的患者有某种程度的持续性症状。可以进行一些简单的数学计算:1700 万人 × 75% 群体免疫临界值 × 2% 病死率 × 90% 预防死亡有效率 = 通过接种 AZC1222 疫苗,已经挽救了 ~230,000 条生命。
5.5.Sputnik V (卫星 V)是俄罗斯 Gamaleya 研究所开发的两种腺病毒载体联合疫苗,当前已在俄罗斯以及亚洲、非洲、中东和南美的多个国家获准使用。对 21,977 名受试者进行的 3 期临床试验发现,有效性为 92%。30 接种 21 天后,该疫苗能 100% 预防重症和死亡。未报告与免疫接种相关的严重不良事件。
6.Coronavac 是中国科兴 (Sinovac) 公司开发的一款 SARS-CoV-2 全病毒灭活苗,当前已在中国以及亚洲和南美洲多个国家获准使用。来自大规模 3 期临床试验的数据当前仅见于新闻报道,但这些数据表明“对 COVID-19 所致疾病的有效率为 51%(对所有病例)、84%(对需要医学治疗的病例)和 100%(对住院、重症和死亡病例)。31
7.BBIBP-CorV 是中国国药集团 (Sinopharm) 开发的一款 SARS-CoV-2 全病毒灭活苗,当前已在中国以及亚洲和南美洲和中东多个国家获准使用。这种疫苗的安全性和有效性数据似乎比 CoronaVac 疫苗更少。维基百科的总结表明,在巴林进行的一项研究中,有效性为 86%,预防重症的有效性为 100%。这些数据尚未公布。
总之,当前已经获准使用的疫苗似乎在预防感染方面有很高的有效性,预防重症和死亡几乎 100% 有效。有一些异常的罕见病例,如使用 mRNA 疫苗时出现的过敏反应,以及使用 AstraZeneca AZD1222 疫苗时可能出现的非常罕见的血栓症病例。考虑到这种安全性和有效性特征,以及严重疫情导致的复杂健康、社会和经济成本,收益与风险比趋近于 1:0。
Steven Shafer , MD 是斯坦福大学医学院的麻醉学、围手术期与疼痛医学教授。
作者没有利益冲突。
参考文献
- Neustadt RE, Fineberg HV. The swine flu affair: decision-making on a slippery disease. Washington (DC): National Academies Press (US); 1978.
- Sivadon-Tardy V, Orlikowski D, Porcher R, et al. Guillain-Barré syndrome and influenza virus infection. Clin Infect Dis. 2009;48:48–56.
- Xie H, Li X, Gao J, Lin Z, et al. Revisiting the 1976 “swine flu” vaccine clinical trials: cross-reactive hemagglutinin and neuraminidase antibodies and their role in protection against the 2009 H1N1 pandemic virus in mice. Clin Infect Dis. 2011;53:1179–87.
- World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed March 25, 2021.
- Regulatory Affairs Professionals Society. COVID-19 vaccine tracker. https://www.raps.org/news-and-articles/news-articles/2020/3/covid-19-vaccine-tracker. Accessed March 25, 2021.
- Polack FP, Thomas SJ, Kitchin N, et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med. 2020;383:2603–2615.
- Henry O, Brzostek J, Czajka H, et al. One or two doses of live varicella virus-containing vaccines: efficacy, persistence of immune responses, and safety six years after administration in healthy children during their second year of life. Vaccine. 2018;36:381–387.
- Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA Covid-19 vaccine in a nationwide mass vaccination setting. N Engl J Med. 2021:NEJMoa2101765. doi: 10.1056/NEJMoa2101765. Epub ahead of print.
- CDC COVID-19 Response Team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Pfizer-BioNTech COVID-19 vaccine – United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep. 2021;70:46–51. doi: 10.15585/mmwr.mm7002e1.
- Turner PJ, Ansotegui IJ, Campbell DE, et al. COVID-19 vaccine-associated anaphylaxis: a statement of the World Allergy Organization Anaphylaxis Committee. World Allergy Organ J. 2021;14:100517.
- Moghimi SM. Allergic reactions and anaphylaxis to LNP-based COVID-19 vaccines. Mol Ther. 2021;29:898–900.
- Gee J, Marquez P, Su J, Calvert GM, et al. First month of COVID-19 vaccine safety monitoring – United States, December 14, 2020–January 13, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:283-288.
- Development and Licensure of Vaccines to Prevent COVID-19 – Department of Health and Human Services, FDA Center for Biologics Evaluation and Research. June 2020
- CDC COVID-19 Response Team; Food and Drug Administration. Allergic reactions including anaphylaxis after receipt of the first dose of Moderna COVID-19 vaccine – United States, December 21, 2020–January 10, 2021. MMWR Morb Mortal Wkly Rep. 2021;70:125–129.
- Cross R. Without these lipid shells, there would be no mRNA vaccines for COVID-19. Chemical & Engineering News. March 2021 (https://cen.acs.org/pharmaceuticals/drug-delivery/Without-lipid-shells-mRNA-vaccines/99/i8). Accessed March 25, 2021.
- Janssen Investigational COVID-19 Vaccine: interim analysis of Phase 3 clinical data released. National Institutes of Health News Release, January 29, 2021 (https://www.nih.gov/news-events/news-releases/janssen-investigational-covid-19-vaccine-interim-analysis-phase-3-clinical-data-released). Accessed March 25, 2021
- Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. FDA Briefing Document. https://www.fda.gov/media/146217/download. Accessed March 25, 2021.
- Voysey M, Clemens SAC, Madhi SA, et al. Oxford COVID Vaccine Trial Group. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2021 Jan 9;397(10269):99–111. doi: 10.1016/S0140-6736(20)32661-1. Epub 2020 Dec 8. Erratum in: Lancet. 2021 Jan 9;397(10269):98. PMID: 33306989; PMCID: PMC7723445.
- Voysey M, Clemens SAC, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials. Lancet. 2021;397:881–891.
- Madhi SA, Baillie V, Cutland CL, et al. Efficacy of the ChAdOx1 nCoV-19 Covid-19 vaccine against the B.1.351 variant. N Engl J Med. 2021. doi: 10.1056/NEJMoa2102214. Epub ahead of print.
- Medicines & Healthcare products Regulatory Agency. Research and analysis: Coronavirus vaccine – weekly summary of Yellow Card reporting. https://www.gov.uk/government/publications/coronavirus-covid-19-vaccine-adverse-reactions/coronavirus-vaccine-summary-of-yellow-card-reporting. Accessed April 5, 2021.
- Reuters. Australia to continue AstraZeneca vaccination despite blood clotting case. https://www.reuters.com/article/us-health-coronavirus-australia/australia-to-continue-astrazeneca-vaccination-despite-blood-clotting-case-idUSKBN2BQ06B. Accessed April 5, 2021.
- Greinacher A, Thiele T, Warkentin TE, et al. A prothrombotic thrombocytopenic disorder resembling heparin-induced thrombocytopenia following Coronavirus-19 vaccination. Research Square Preprint Server. DOI: 10.21203/rs.3.rs-362354/v1.
- World Health Organization. Statement of the WHO Global Advisory Committee on Vaccine Safety (GACVS) COVID-19 subcommittee on safety signals related to the AstraZeneca COVID-19 vaccine. https://www.who.int/news/item/19-03-2021-statement-of-the-who-global-advisory-committee-on-vaccine-safety-(gacvs)-covid-19-subcommittee-on-safety-signals-related-to-the-astrazeneca-covid-19-vaccine.Accessed March 25, 2021.
- AstraZeneca. Update on the safety of COVID-19 Vaccine AstraZeneca. March 14, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/update-on-the-safety-of-covid-19-vaccine-astrazeneca.html. Accessed March 25, 2021.
- AstraZeneca. AZD1222 US Phase III trial met primary efficacy endpoint in preventing COVID-19 at interim analysis. March 22, 2021. https://www.astrazeneca.com/media-centre/press-releases/2021/astrazeneca-us-vaccine-trial-met-primary-endpoint.html. Accessed March 25, 2021.
- National Institues of Health. NIAID statement on AstraZeneca vaccine. https://www.nih.gov/news-events/news-releases/niaid-statement-astrazeneca-vaccine. Accessed March 25, 2021.
- Mallapaty S, Callaway E. What scientists do and don’t know about the Oxford-AstraZeneca COVID vaccine. March 24, 2021. https://www.nature.com/articles/d41586-021-00785-7. Accessed March 25, 2021.
- Guidance produced from the Expert Haematology Panel (EHP) focussed on syndrome of thrombosis and thrombocytopenia occurring after coronavirus vaccination. https://b-s-h.org.uk/media/19498/guidance-version-07-on-mngmt-of-thrombosis-with-thrombocytopenia-occurring-after-c-19-vaccine_20210330_.pdf. Accessed April 6, 2021.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397:671–681.
- Mallapaty, S. China COVID vaccine reports mixed results — what does that mean for the pandemic? Nature. January 15, 2021. https://www.nature.com/articles/d41586-021-00094-z. Accessed March 25, 2021.
- Source: Steve’s Daily COVID-19 update, distributed by the author daily except Sunday. The update is freely available. To be added to the distribution list just send me an e-mail ([email protected]). Case and death data are from the repository maintained by Johns Hopkins.
- World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. April 6, 2021. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines. Accessed April 6, 2021.
自本文发表以来,强生公司疫苗似乎与血栓综合征和低血小板症有关(请参见 https://www.cdc.gov/coronavirus/2019-ncov/vaccines/safety/JJUpdate.html)。发生率似乎约为 1 例/百万剂疫苗。尽管已经对相关性进行了研究,并找出了风险因素,但 CDC 还是建议暂停接种。2021 年 4 月 23 日,CDC 和 FDA 取消了暂停强生公司疫苗接种的禁令,引述的理由是疫苗的潜在收益大于其风险。


 Issue PDF
Issue PDF